
Revista Cubana de Ciencias Forestales. 2020; septiembre-diciembre 8(3): 495-506
Poder germinativo de Polylepis incana con aplicación de diferentes tratamientos de agua
Germination power of Polylepis incana with application of different water treatments
Poder germinativo da Polylepis incana com aplicação de diferentes tratamentos de água
Ángel Canales Gutiérrez1* ![]() https://orcid.org/0000-0002-3096-1705
https://orcid.org/0000-0002-3096-1705
Yanina Ruth Huarasa Vilca1 ![]() https://orcid.org/0000-0001-8700-8192
https://orcid.org/0000-0001-8700-8192
1Institución de adscripción: Programa de Ecología de la Facultad de Ciencias Biológicas de la Universidad Nacional del Altiplano de Puno. Perú
*Autor para la correspondencia: acanales@unap.edu.pe
Recibido: 31 de agosto de 2020.
Aprobado: 2 de octubre de 2020.
RESUMEN
Polylepis incana Kunth (queñoa), es una especie que posee diversos usos locales, sin embargo, presenta un bajo poder germinativo en condiciones naturales. El objetivo de la investigación fue comparar el poder germinativo de Polylepis incana, con tratamientos de agua de coco, residual y de pozo. Se instaló un experimento con tres tipos de agua y cinco dosis de agua (5, 10, 15, 20 y 25 ml). La germinación se desarrolló en 15 bandejas, en cada una se adicionó 750 g de sustrato y 20 semillas. El riego se realizó diariamente con diferentes cantidades de agua, desde 5 a 25 ml. Se registró el porcentaje de poder germinativo, temperatura y pH del suelo de forma diaria. Los análisis estadísticos fueron realizados en el programa INFOSTAT. El mayor poder germinativo de semillas, se registró con riegos con agua residual (9 %), mientras que las semillas regadas con agua de coco y de pozo alcanzaron un 4 %. Por tanto, se ha obtenido un 9 % de poder germinativo de semillas de P. incana, regadas con agua residual.
Palabras clave: Germinación; invernadero; Polylepis incana; riego; Tratamiento.
ABSTRACT
Polylepis incana Kunth (queñoa), is a species that has diverse local uses; however, it has a low germination power in natural conditions. The objective of this research was to compare the germination power of Polylepis incana, with coconut, residual and untreated water treatments. An experiment was set up with three types of water and five doses of water (5, 10, 15, 20 and 25 ml). The germination was developed in 15 trays, in each one 750 g of substrate and 20 seeds were added. The irrigation was done daily with different amounts of water, from 5 to 25 ml. The percentage of germination power, temperature and soil pH were recorded daily. The statistical analyses were carried out in the INFOSTAT program. The highest germination power of seeds was registered with irrigation with residual water (9 %), while seeds irrigated with coconut and untreated water reached 4 %. Therefore, a 9 % germination power of P. incana seeds, irrigated with residual water, was obtained.
Keywords: Germination; Greenhouse; Polylepis incana; Irrigation; Treatment.
RESUMO
Polylepis incana Kunth (queñoa), é uma espécie que tem várias utilizações locais, no entanto, apresenta um baixo poder germinativo em condições naturais. O objetivo da investigação era comparar o poder germinativo da Polylepis incana, com tratamentos de coco, resíduos e água de poços. Foi realizada uma experiência com três tipos de água e cinco doses de água (5, 10, 15, 20 e 25 ml). A germinação foi desenvolvida em 15 tabuleiros, em cada um deles foram adicionados 750 g de substrato e 20 sementes. A irrigação foi feita diariamente com diferentes quantidades de água, de 5 a 25 ml. A percentagem do poder germinativo, temperatura e pH do solo foram registados diariamente. As análises estatísticas foram levadas a cabo no programa INFOSTAT. O maior poder germinativo das sementes foi registado com irrigação com água residual (9 %), enquanto as sementes irrigadas com coco e água de poço atingiram 4 %. Portanto, 9 % do poder germinativo foi obtido a partir de sementes de P. incana irrigadas com águas residuais.
Palavras-chave: Germinação; estufa; Polylepis incana; irrigação; tratamento.
INTRODUCCIÓN
Polylepis incana (Wesche et al., 2008), es una angiosperma, dicotiledónea (Renison y Cingolani 1998), tiene una gran diversidad de especies que están presentes en Sudamérica (Montesinos-Tubée et al., 2015; Abdellaoui et al., 2019) y distribuidas a lo largo de Los Andes (Vega-Krstulovic et al., 2007). La mayor diversidad de especies se encuentra entre las altitudes de 3 000 m s.n.m. (Kessler y Schmidt-Lebuhn 2006) hasta 4 600 m s.n.m. (Domic y Capriles 2009), siendo árboles y algunos, arbustos (Mendoza y Cano 2011).
La especie P. incana, es endémica de Perú (Castro y Flores 2015), posee una altura de dos a cinco metros de altura (Seltmann et al., 2007), se caracteriza principalmente por presentar tallos torcidos (Argibay y Renison 2018) y de crecimiento lento (Domic et al., 2013), pero con adaptaciones a bajas temperaturas (Hidalgo et al., 2013).
Actualmente los bosques de Polylepis, constituyen uno de los ecosistemas más vulnerables del continente americano (Castro y Flores 2015), debido a los factores ambientales (Arana-Paredes et al., 2015), bajas tasas de regeneración (Argollo et al., 2004; Seltmann et al., 2007), uso intensificado del suelo (Argollo et al., 2004), cambio climático (Domic et al., 2013), intensa presión por expansión de la agricultura (Domic et al., 2017) y degradación de su hábitat (Seltmann et al., 2007).
Diversos esfuerzos se han realizado para promover su germinación y propagación de la especie P. incana, sin embargo, existen dificultades en procesos reproductivos genéticos, que son propios de la planta (Zutta et al., 2012), como restricciones a variaciones de temperatura (Landi y Renison 2010), escasa dispersión de semillas en forma natural (Wesche et al., 2008), esto provoca regeneración lenta de los bosques de Polylepis (Enrico et al., 2004). De las semillas coleccionadas en el medio natural, solo el 10 % son óptimas para el sembrío (Montesinos-Tubée et al., 2015), ellas son afectadas por la temperatura baja en su hábitat natural (Simoes y Renison 2015; Pulido y Ramos 2016), la evapotranspiración del suelo (Rosero et al., 2018), la variabilidad del clima (Zutta et al., 2012) con efectos impredecibles en la germinación de las semillas.
Diversos estudios han demostrado que la P. incana, posee bajo porcentaje de germinación pudiendo alcanzar sólo entre 3 % y 5 % (Enrico et al., 2004; Domic et al., 2017), con la posibilidad de germinar en distintos sustratos: arena, tierra, rocas y buen preparado de la tierra (Renison y Cingolani 1998; Olivera et al., 2018). El buen desarrollo de las semillas, depende de los parámetros de la calidad del agua que se utiliza para el riego (Torres et al., 2008); las condiciones ambientales en las que se encuentra (Renison et al., 2004) y los ajustes osmóticos de la semilla (Domic y Capriles 2009).
Las aguas tratadas, pueden ser utilizadas para riego de plantas (Passarini et al., 2012), asimismo el riego con aguas residuales, potencian la capacidad de germinación y fertilidad de la plántula (Cardonell et al., 2012), debido a que tiene gran cantidad de nutrientes como nitrógeno y fósforo (Beltrán et al., 2015). Por ejemplo, el agua de coco promueve la germinación a niveles máximos (Patiño et al., 2011), porque contiene hormonas con acción citoquinina del tipo isoprenoide, ello fomenta el proceso de la división celular, así influyendo en el proceso post germinativo (Del Pozo et al., 2005; Quinto et al., 2009), siendo el agua de coco promotor de la germinación, con temperaturas entre 16°C y 20°C (Arana et al., 2015).
La importancia de investigar la viabilidad germinativa de la P. incana, está fundamentada por el uso que realizan las poblaciones locales (Capriles y Flores 2002), como, por ejemplo: uso como leña (Kessler y Schmidt 2006; Wesche et al., 2008) y medicinal, pues actúa como antihipertensivo (Daud et al., 2007), y también como forraje para los animales (Castañeda y Albán 2016). La protección y conservación de los bosques de P. incana, a partir de la siembra por semillas, es por la cobertura vegetal que proporciona en los ecosistemas andinos (Schmidt-Lebuhn et al., 2006), por su participación en la regulación de la escorrentía, control de la erosión (Delgado y León-Vargas 2017), su capacidad de retener y capturar agua, siendo el principal tipo de cobertura en las cuencas hidrográficas altoandinas (Enrico et al., 2004).
El frío perjudica a las semillas, provocando daños fisiológicos retardando el crecimiento, por tanto, es adecuada la propagación en primavera; los plantones germinados por semilla son más factibles que los plantones por estaca (Vasco 2010), las semillas de P. incana, poseen un alto grado de impureza (Vega et al., 2018). Las respuestas germinativas de las semillas de Polylepis incana, en condiciones de invernadero muestran mayor porcentaje de germinación de aproximadamente 19 %.
El objetivo de la investigación fue comparar el poder germinativo de Polylepis incana, con tratamientos de agua (residual, coco y pozo).
MATERIALES Y MÉTODOS
Zona de estudio
La investigación se realizó en el invernadero de la Oficina de Gestión Ambiental de la Universidad Nacional del Altiplano de Puno, ubicado en 15°49'34" latitud sur, 70°00'19" longitud oeste y a una altitud de 3816 m s.n.m. (Figura 1).
Figura 1 - Mapa de localización del Invernadero de la Universidad Nacional del Altiplano de Puno, Perú
Diseño del experimento
La siembra se realizó in vitro, se sembraron 300 semillas de P. incana, en quince bandejas de plástico, se distribuyeron 20 semillas por bandeja con ayuda de pinzas de disección estériles. Se pusieron dentro de las bandejas de 100 g de sustrato tamizado de tierra negra, arena y estiércol de ovino; las bandejas con semillas se colocaron en una mesa bajo la intensidad luminosa del sol.
Para evaluar el efecto del tipo de agua, se utilizó agua de coco, habiéndose comprado 13 cocos para todo el proceso de la investigación; agua contaminada, se extrajo de la bahía interior de Puno y el agua de pozo de un manantial ubicado en la ciudad de Puno (Jr. Independencia y Av. La Torre). Asimismo, se registró la temperatura ambiental del invernadero donde se obtuvo un promedio de 25°C.
El experimento tuvo cinco dosis de riego con tres tratamientos; el primer tratamiento (T1), fue de agua de coco, la primera fue con dosis de riego de 5 ml, la segunda repetición fue con 10ml, la tercera fue de 15 ml, la cuarta fue con 20 ml y la quinta fue con 25 ml. Con el segundo tratamiento (T2) fue de agua residual y el tercer tratamiento (T3) con agua de pozo, las dosis fueron con las mismas cantidades de riego para los tres tratamientos.
De forma semanal, se monitoreó el pH, humedad y temperatura (°C) del sustrato; el pH y humedad se midieron con un pH metro HANNA, Checker, USA y la temperatura con un termómetro infrarrojo Oaklon, Mini infraPro 6, USA.
Evaluación de la germinación
Para evaluar la germinación in vitro se registró interdiario el número de semillas germinadas desde el tercer día posterior a la siembra, luego de se determinó el porcentaje de germinación, y se calculó teniendo en cuenta el número de semillas germinadas, respecto al número inicial de semillas puestas a germinar.
Análisis estadísticos:
El diseño experimental fue completamente aleatorio con cinco dosis de agua y cada una con 20 semillas. Los datos fueron sometidos a una prueba estadística no paramétrica de Kruskal-Wallis, para contrastar la influencia de la cantidad de riego y número de semillas germinadas y también se aplicó la prueba de correlación para estimar el grado de asociación entre temperatura y pH del sustrato. El promedio de temperatura fue de 27,5°C y pH de 7,6. Los datos fueron analizados utilizando el programa INFOSTAT versión 2018.
RESULTADOS
De 300 semillas sembradas de Polylepis incana, germinaron en total 17 semillas, de esta cantidad nueve semillas germinaron con riego de agua residual, cuatro semillas germinadas con riego de agua de coco y cuatro semillas germinadas con riego de agua de pozo.
Las semillas de P. incana, que fueron regadas con agua residual y en una mezcla de sustrato que fue de tierra negra, arena y como fertilizante estiércol de ovino, germinaron nueve semillas las cuales equivale al 9 % de un total de 100 semillas sembradas, mientras que las semillas regadas con agua de coco y pozo, germinaron cuatro semillas (4 %), respectivamente (Figura 2).
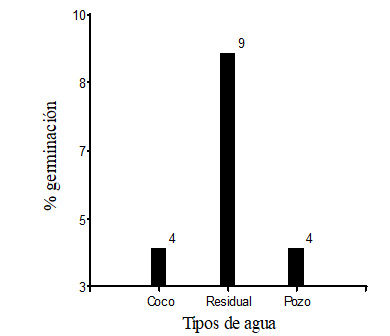
Figura 2 - El número de semillas germinada sujeta a los diferentes tipos de agua (coco, residual y pozo)
Las diferentes cantidades de dosis de agua, aplicadas para el riego de las semillas sembradas en sustrato de tierra negra, arena y como fertilizante estiércol de ovino, no presentaron diferencias estadísticas en la germinación de semillas de P. incana (Hcalc (0,05) =0,83; P=0,85)
El análisis de correlación entre la temperatura y pH, fue de r=0,14, esto implica una baja correlación o afinidad entre estas dos variables dependientes para la germinación de la semilla, por tanto, las dos variables pueden actuar indistintamente, sin afectar el poder germinativo de la P. incana (Figura 3). Las variaciones de temperatura dentro del invernadero, tuvieron rangos de promedio de 22,67 a 31,13°C, siendo factores influyentes en la germinación de semillas. La temperatura del sustrato, donde se sembró la semilla de P. incana, que fueron regadas con agua residual, presentaron registros promedios de 27,5°C y pH de 7,6.
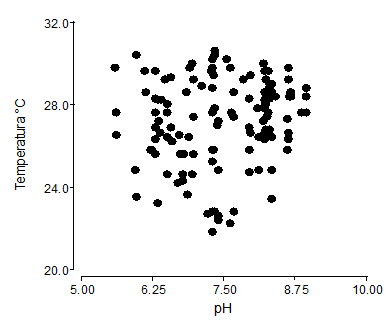
Figura 3 - Correlación de Pearson de temperatura (°C) y pH en los sustratos para el proceso germinativo de P. incana r= 0,14
DISCUSIÓN
Las diferentes de dosis de agua, aplicadas a la germinación de semillas, no influyen en la germinación de las semillas de P. incana, sin embargo, los tipos de agua de riego, sí influyen en el número de semillas germinadas. El poder germinativo de las plantas está limitado por las dificultades reproductivas por problemas genético propias de la planta (Zutta et al., 2012), es por eso que, en el tratamiento con agua de coco, solo hubo una germinación del 4 %, en el agua residual del 9 % y en el agua pozo de 4 %. Estos porcentajes son coincidentes con lo mencionado por (Argibay y Renison 2018), donde indica que tan solo el 10 % de las semillas coleccionadas de forma natural son óptimas para el sembrío y además la viabilidad de germinación, se deben también a las restricciones climáticas adversas (Pulido y Ramos 2016) y la escasa dispersión en forma natural (Wesche et al., 2008).
Asimismo, es importante mencionar que la temperatura influye en la germinación de la P. incana (Delgado y León 2017) y estas especies que se encuentran por encima de los 4000 m s.n.m., son afectadas por la adversidad de las bajas temperaturas que se presentan en el lugar (Simoes y Renison 2015). En la investigación, el estar dentro de un invernadero, fue favorable para el porcentaje germinativo de las semillas de P. incana, debido a que los registros de temperatura fluctuaron entre un rango promedio de 22,67 a 31,13°C. El rango óptimo para la germinación de P. incana, según nuestra investigación, registra de 16,8 a 20,6°C, porque cuando la temperatura promedio del día llegaba a esos rangos, las semillas reaccionan óptimamente y también depende de la cantidad de riego que se realiza.
En el tratamiento con agua de coco, hubo una menor germinación que fue del 4 %, a pesar de presentar vitaminas y sustancias químicas con acción promotora sobre la germinación del más del 50 % (Santos et al., 2013), sin embargo, en el 100 % de las semillas sembradas, no fue favorable, es probable que pueda funcionar en otras especies, porque el agua de coco fue utilizada para promover la germinación de muchas especies, como el clavel, debido a que el agua de coco presenta aminoácidos y antioxidantes (Arana-Paredes et al., 2015). Según Quinto et al., (2009), indica que el agua de coco, puede ser promotor de la germinación, a temperaturas entre 16°C y 20°C (Arana-Paredes et al., 2015).
Sin embargo, en la investigación, con el riego con agua de coco, las temperaturas dentro del invernadero oscilaban de 22,67 a 31,13°C, por tal motivo, el agua de coco, comenzó a fermentarse, provocando la formación de hongos alrededor de las semillas y ésta situación ha podido influir en la germinación, principalmente en las que fueron regadas con 10, 15, 20, 25 ml; en donde no hubo germinación, sin embargo, con 5 ml, si hubo germinación.
En el tratamiento de agua residual hubo un mayor porcentaje de germinación: del 9 %, cabe resaltar que el desarrollo de las semillas depende de los parámetros de calidad de agua que influyen en la tierra (Torres et al., 2008) porque el agua residual tiene una demanda bioquímica (Cardonell et al., 2012) y además, posee una gran cantidad de nutrientes de nitrógeno y fósforo, principalmente, el agua que se utilizó, que fue de la Bahía interior de Puno (Beltrán et al., 2015) y en las semillas que fueron regadas con 5ml en forma diaria, se obtuvo un mejor rendimiento y mayor número semillas germinadas, pero las que fueron regadas con 10, 20, 25 ml, no hubo germinación, entonces, a menor abundancia de agua dentro de los tratamientos, hay mayor número de semillas germinadas. Según Enrico et al., (2004) las plantas tienen la capacidad de retener y capturar agua en su organismo, esto demuestra que para P. incana, con mínima cantidad de agua puede germinar la semilla.
En esta investigación, se logró obtener un 9 % de poder germinativo de las semillas de P. incana, mientras que, en forma natural, sólo son viables hasta 3 % (Domic et al., 2017). Esta situación, es alentadora para los resultados, debido a que las especies nativas poseen un bajo nivel de regeneración (Gutiérrez y Becerra 2018).
Con los resultados obtenidos de esta investigación, aportamos conocimiento para que las instituciones públicas y privadas, puedan promover la producción de plántulas de P. incana a partir de la germinación de semillas, regadas con agua residual tratada, pues estas aguas aún son adecuadas para el riego, debido a que contienen nitrógeno y fósforo. Luego, las plántulas pueden ser trasplantadas en su hábitat natural, evitando su proceso de disminución de los bosques relictos de Polylepis en la región alto andina peruana.
CONCLUSIONES
Se ha registrado un 9 % de poder germinativo de las semillas de Polylepis incana sembradas en el tratamiento con riego de agua residual, siendo menores las semillas germinadas con riego de agua de coco y de pozo.
A un suministro de riego de 5 ml, existe un mayor número de semillas germinadas, por tanto, las semillas de Polylepis no necesitan abundante agua para su desarrollo.
Existe un bajo grado de afinidad entre la temperatura y pH del sustrato, esto implica no dependencia de estos parámetros para la germinación de la semilla de P. incana.
AGRADECIMIENTOS
A la Oficina de Gestión Ambiental de la Universidad Nacional del Altiplano de Puno, por las facilidades brindadas para la realización de este estudio y al laboratorio de Ecología de la Facultad de Ciencias Biológicas; por facilitarnos el uso de diferentes equipos y materiales. Este estudio fue apoyado por la Oficina de Gestión Ambiental y fondos para investigación formativa de la Universidad Nacional del Altiplano de Puno.
REFERENCIAS BIBLIOGRÁFICAS
ABDELLAOUI, R., BOUGHALLEB, F., ZAYOUD, D., NEFFATI, M. y BAKHSHANDEH, E., 2019. Quantification of Retama raetam seed germination response to temperature and water potential using hydrothermal time concept. Environmental and Experimental Botany [en línea], vol. 157, pp. 211216. Disponible en doi: https://doi.org/10.1016/j.envexpbot.2018.10.014
ARANA-PAREDES, M., RENGIFO, S. y CHICO-RUIZ, J., 2015. Germinación in vitro de Dianthus caryophyllus en diferentes medios de cultivo. Sagasteguiana [en línea], vol. 3, no. 1, pp. 5566. Disponible en: http://revistas.unitru.edu.pe/index.php/REVSAGAS/article/view/2009/1922
ARGIBAY, D. y RENISON, D., 2018. Efecto del fuego y la ganadería en bosques de Polylepis australis (Rosaceae) a lo largo de un gradiente altitudinal en las montañas del centro de la Argentina. Bosque [en línea], vol. 39, no. 1, pp. 145-150. Disponible en doi: https://doi.org/10.4067/S0717-92002018000100145
ARGOLLO, J., SOLIZ, C. y VILLALBA, R., 2004. Potencialidad dendrocronológica de Polylepis tarapacana en los Andes Centrales de Bolivia. Ecología en Bolivia [en línea], vol. 39, no. 1, pp. 5-24. Disponible en: http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S1605-25282004000700002
BELTRÁN, D., PALOMINO, R., MORENO, E., PERALTA, C., y MONTESINOS, D., 2015. Calidad de agua de la bahía interior de Puno, lago Titicaca durante el verano del 2011. Revista Peruana de Biología [en línea], vol. 22, no. 3, pp. 335-340. Disponible en doi: http://dx.doi.org/10.15381/rpb.v22i3.11440
CAPRILES, J. y FLORES, E., 2002. The economic, symbolic, and social imporatnce of the "keñua" (Polylepis spp.) during prehispanic times in the andean highlands of Bolivia. Ecotropia [en línea], vol. 8, pp. 225-235. Disponible en: http://saberesbolivianos.com/investigadores/Capriles/Capriles%20&%20Flores%202002.pdf
CARDONELL, M., FLÓREZ, M., MARTÍNES E. y PRIETO, A., 2012. Germinación de pratenses regadas con agua residual depurada. Ingeniería de Recursos Naturales y del Ambiente [en línea], vol. 11, pp. 73-82. Disponible en: http://www.redalyc.org/articulo.oaid=231125817011
CASTAÑEDA, R. y ALBÁN, J., 2016. Importancia cultural de la flora silvestre del distrito de Pamparomás, Ancash, Perú. Ecología Aplicada [en línea], vol. 15, no. 2, pp. 151-169. Disponible en doi: http://dx.doi.org/10.21704/rea.v15i2.755
CASTRO, A. y FLORES, M., 2015. Caracterización de un bosque de queñual (Polylepis spp.) ubicado en el distrito de Huasta, provincia de Bolognesi (Ancash, Peú). Ecología Aplicada [en línea], vol. 14 no. 1, pp. 1-10. Disponible en: http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1726-22162015000100001
DAUD, A., HABIB, N. y RIERA, A., 2007. Actividad diurética de extracto acuoso de Polylepis australis (queñoa) y Phrygilanthus acutifolius (corpo). Estudio comparativo en ratas. Farmacología y Actividad Biológica [en línea], vol. 6, no. 6, pp. 337-339. Disponible en: https://www.redalyc.org/articulo.oa?id=85617472013
DEL POZO J.C., LOPEZ-MATAS, M.A., RAMIREZ-PARRA, E. y GUTIERREZ, C., 2005. Hormonal control of the plant cell cycle. Plant Physiol [en línea], vol. 123, no. 2, pp. 173-183. Dosponible en doi: https://doi.org/10.1111/j.1399-3054.2004.00420.x
DELGADO, J. y LEÓN-VARGAS, Y., 2017. Musgos (Bryophyta) de bosques de Polylepis sericea (Rosaceae) del estado Mérida (Venezuela). Boletín De La Sociedad Argentina De Botánica [en línea], vol. 52, no. 2,pp. 295313. Disponible en doi: https://doi.org/10.31055/1851.2372.v52.n2.17445
DOMIC, A. y CAPRILES, J., 2009. Allometry and effects of extreme elevation on growth velocity of the Andean tree Polylepis tarapacana Philippi (Rosaceae). Plant Ecology [en línea], vol. 205, no. 2, pp. 223234. Disponible en doi: http://dx.doi.org/10.1007/s11258-009-9612-5
DOMIC, A., MAMANI E. y CAMILO, G., 2013. Fenologia reproductiva de la kewiña (Poylepis tomentella, Rosaceae) en la puna semihúmeda de Chuquisaca (Bolivia). Ecologia en Bolivia [en línea], vol. 48, no. 1, pp. 3145. Disponible en: http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S1605-25282013000100004
DOMIC, A., PALABRAL-AGUILERA, A., GÓMEZ, M., HURTADO, R., ORTUÑO N. y LIBERMAN, M., 2017. Polylepis incarum (Rosaceae) una especie en peligro crítico en Bolivia: Propuesta de reclasificación en base al área de ocupación y estructura poblacional. Ecología en Bolivia [en línea], vol. 52, no. 2, pp. 116-131. Disponible en: http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S1605-25282017000200006
ENRICO, L., FUNES, G. y CABIDO, M., 2004. Regeneration of Polylepis australis Bitt. in the mountains of central Argentina. Forest Ecology and Management [en línea], vol. 190, no. 23, pp. 301309. Disponible en doi: https://dx.doi.org/10.1016/j.foreco.2003.10.020
GUTIÉRREZ, I. y BECERRA, P., 2018. Composición, diversidad y estructura de la vegetación de bosques ribereños en el centro sur de Chile. Bosque [en línea], vol. 39, no. 2, pp. 239-253. Disponible en doi: http://doi.org/10.4067/S0717-92002018000200239
HIDALGO, F., BUSTAMANTE, V., MUÑOZ, F., SERRA, M., RIOSECO, T. y CARDOZO, C., 2013. Estructura de una población de queñoa (Polylepis tarapacana Phil), Carcanal de Ujina, región de Tarapacá, Chile. Geobiota, 2pp
KESSLER, M. y SCHMIDT-LEBUHN, A., 2006. Taxonomical and distributional notes on Polylepis (Rosaceae). Organisms Diversity and Evolution [en línea], vol. 6, no. 1, pp. 6769. Disponible en doi: https://doi.org/10.1016/j.ode.2005.04.001
LANDI, M. y RENISON, D., 2010. Forestación con Polylepis australis en suelos erosionados de las Sierras Grandes de Córdoba: evaluación del uso terrazas y vegetación nodriza. Ecología Austral [en línea], vol. 20, pp. 47-55. Disponoble en: https://ri.conicet.gov.ar/handle/11336/53237?show=full
MENDOZA, W. y CANO, A., 2011. Diversidad del género Polylepis (Rosaceae, Sanguisorbeae) en los andes peruanos. Revista Peruana de Biologia [en línea], vol. 18, no. 2, pp. 197-200. Disponible en: http://www.scielo.org.pe/scielo.php?pid=S1727-99332011000200011&script=sci_abstract
MONTESINOS-TUBÉE, D., PINTO, A., BELTRÁN, D. y GALIANO, W., 2015. Vegetación de un bosque de Polylepis incarum (Rosaceae) en el distrito de Lampa, Puno, Perú. Revista Peruana de Biologia [en línea], 22(1): 8796. Disponible en doi: https://doi.org/10.15381/rpb.v22i1.11125
OLIVERA, M., CARVALHO, D., GOMES, D., PEREIRA, F. y MEDICI, L., 2018. Production of cut sunflower under water volumes and substrates with coconut fiber Produção de girassol de corte sob volumes de água e substratos com fibra de coco. Revista Brasileira de Engenharia Agrícola e Ambiental [en línea], vol. 22, no. 12, pp. 859865. Disponible en doi: http://dx.doi.org/10.1590/1807-1929/agriambi.v22n12p859-865.
PASSARINI, K., GAMARRA, F., VANALLE, R. y SANTANA, J., 2012. Reutilización de las aguas residuales en la irrigación de plantas y en la recuperación de los suelos. Información Tecnológica [en línea], vol. 23, no. 1, pp. 57-64. Disponible en doi: http://dx.doi.org/10.4067/S0718-07642012000100007
PATIÑO, C., MOSQUERA, F. y TULIO, G. 2011. Efecto inductor del agua de coco sobre la germinación de semillas y brotamiento de los cormos de la hierba de la equis (Dracontium ryumianum). Acta Biológica Colombiana [en línea], vol. 16, no. 1, pp. 133-142. Disponible en: http://www.redalyc.org/articulo.oa?id=319027887010
PULIDO, K. y RAMOS, C., 2016. Efecto de borde en la distribución de líquenes y el contenido de clorofilas en fragmentos de Polylepis quadrijuga (Rosaceae) en el páramo de La Rusia (Boyacá-Colombia). Revista de Biología Tropical [en línea], vol. 64, no. 4, pp. 1683-1697. Disponible en doi: http://dx.doi.org/10.15517/rbt.v64i4.22735
QUINTO, L., MARTÍNEZ-HERNÁNDEZ, P.A., PIMENTEL-BRIBIESCA, L. y RODRÍGUEZ-TREJO, D.A., 2009. Alternativas para mejorar la germinación de semillas de tres árboles tropicales. Revista Chapingo. Serie ciencias forestales y del medio ambiente [en línea], vol. 15, no. 1, pp. 23-28. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007 -40182009000100003
RENISON, D. y CINGOLANI, A., 1998. Experiencias en germinación y reproducción vegetativa aplicados a la reforestación con Polylepis australis (Rosaceae) en las Sierras de Córdoba, Argentina. Agriscientia [en línea], vol. 15, pp. 47-53. Disponible en: https://revistas.unc.edu.ar/index.php/agris/article/view/2607
RENISON, D., HENSEN, I. y CINGOLANI, A., 2004. Anthropogenic soil degradation affects seed viability in Polylepis australis mountain forests of central Argentina. Forest Ecology and Management [en línea], vol. 196 no. 2-3, pp. 327-333. Disponible en doi: https://doi.org/10.1016/j.foreco.2004.03.025
ROSERO, S., ARCOS, J., GUALLPA, M. y GUARACA, F., 2018. Efecto de la aplicación de solución nutritiva para el crecimiento inicial de Polylepis racemosa a nivel de vivero. Enfoque UTE [en línea], vol. 9, no. 2, pp. 198-207. Disponible en: 10.29019/enfoqueute.v9n2.207 (consultado junio de 2019)
SANTOS, J., BISPO, V., FILHO, A., PINTO, I., DANTAS, L., VASCONCELOS, D., ABREU, F., MELO, D., MATOS, I., FREITAS, F., GOMES, O., MEDEIROS, M. y MATOS, H., 2013. Evaluation of chemical constituents and antioxidant activity of coconut water (Cocus nucifera L.) and caffeic acid in cell culture. Anais da Academia Brasileira de Ciencias [en línea], vol. 85, no. 4, pp. 1235-1246. Disponible en doi: http://dx.doi.org/10.1590/0001-37652013105312
SCHMIDT-LEBUHN, A., KUMAR M. y KESSLER, M., 2006. An assessment of the genetic population structure of two species of Polylepis Ruiz y Pav. (Rosaceae) in the Chilean Andes. Flora [en línea], vol. 201, no. 4, pp. 317-325. Disponible en doi: https://dx.doi.org/10.1016/j.flora.2005.07.007
SELTMANN, P., RENISON, D., COCUCCI, A., HENSEN, I. y JUNG, K., 2007. Fragment size, pollination efficiency and reproductive success in natural populations of wind-pollinated Polylepis australis (Rosaceae) trees. Flora [en línea], vol. 202, no.7, pp. 547-554. Disponible en doi: https://doi.org/10.1016/j.flora.2006.12.002
SIMOES, N. y RENISON, D., 2015. ¿Cuántos años monitorear el éxito de plantaciones con fines de restauración?: Análisis en relación al micrositio y procedencia de las semillas. Bosque [en línea], vol. 36, no. 2, pp. 315-322. Disponible en doi: https://doi.org/10.4067/S0717-92002015000200016
TORRES, R., RENISON D., HENSEN I., SUAREZ R. y ENRICO L. 2008. Polylepis australis' regeneration niche in relation to seed dispersal, site characteristics and livestock density. ScienceDirect, vol. 254, pp. 255-260. Disponible en doi:10.1016/j.foreco.2007.08.007
VASCO, S., 2010. Tratamiento para promover la germinación de semillas de Polylepis reticulata Hieron y Polylepis lanuginosa Kunth. Universidad del Azuyo. Facultad de Ciencia y Tecnología. Disponible en: http://dspace.uazuay.edu.ec/handle/datos/162
VEGA, C., VELLEGAS, C., ROCABADO, P., QUEZADA, J., LÓPEZ, M. y QUEVEDO, A., 2018. Biología reproductiva de tres especies de Polylepis (P. neglecta, P. incarum y P. pacensis), con énfasis en su comportamiento germinativo. Ecología Austral. [en línea], vol. 28, pp. 310-324. Disponible en doi: https://doi.org/10.25260/EA.18.28.1.1.703
VEGA-KRSTULOVIC, C., BERMEJO-FRANCO, J., VILLEGAS-ALVARADO, G., QUEZADA-PORTUGAL, J., AGUILAR-LLANOS M. y CONDE-VELASCO, E., 2007. Propagación masiva de Polylepis tomentella Weddell ssp . nana mediante técnicas de cultivo in vitro. Ecología en Bolivia [en línea], vol. 39, no. 2, pp. 102-120. Disponible en: http://www.scielo.org.bo/scielo.php?script=sci_abstract&pid=S1605-25282007000800003&lng=pt&nrm=iso&tlng=es
WESCHE, K., CIERJACKS, A., ASSEFA, Y., WAGNER, S., FETENE, M. y HENSEN, I., 2008. Recruitment of trees at tropical alpine treelines: Erica in Africa versus Polylepis in South America. Taylor & Francis [en línea], vol. 0874, no. 1, pp. 35-46. Disponible en doi: https://doi.org/10.1080/17550870802262166
ZUTTA, B., RUNDEL, P., SAATCHI, S., CASANA, J., GAUTHIER, P., SOTO, A., VELAZCO, Y. y BUERMANN, W., 2012. Prediciendo la distribución de Polylepis: bosques Andinos vulnerables y cada vez más importantes. Revista Peruana de Biología [en línea], vol. 19, no. 2, pp. 205-212. Disponible en: http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1727-99332012000200013
Conflicto de intereses:
Los autores declaran no tener conflictos de intereses.
Contribución de los autores:
Los autores han participado en la redacción del trabajo y análisis de los documentos.
![]()
Esta obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial
4.0 Internacional.
Copyright (c) 2020 Ángel Canales Gutiérrez, Yanina Ruth Huarasa Vilca