
Revista Cubana de Ciencias Forestales. 2020; septiembre-diciembre 8(3): 535-549
Caracterización de la colonización por micorrizas en Retrophyllum rospigliossi Pilger en el bosque Huamantanga, Perú
Characterization of colonization by micorhizae in Retrophyllum rospigliossi Pilger in the Huamantanga forest, Peru
Caracterização da colonização por micorrizos em Retrophyllum rospigliossi Pilger na floresta Huamantanga, Perú
Marcela Nancy Arteaga Cuba1* ![]() https://orcid.org/0000-0003-2793-288X
https://orcid.org/0000-0003-2793-288X
Segundo Medardo Tafur
Santillán1![]() https://orcid.org/0000-0002-4240-4658
https://orcid.org/0000-0002-4240-4658
Germán Pérez Hurtado1![]() https://orcid.org/0000-0003-3289-1859
https://orcid.org/0000-0003-3289-1859
Sigilberto Antonio Pastor Ordinola1![]() https://orcid.org/0000-0003-1745-8547
https://orcid.org/0000-0003-1745-8547
Amado Batista Mainegra2 ![]() https://orcid.org/0000-0002-0130-2874
https://orcid.org/0000-0002-0130-2874
1Universidad Nacional de Cajamarca. Perú.
2Universidad de La Habana. La Habana, Cuba.
*Autor para la correspondencia: marteaga@unc.edu.pe
Recibido 11 de agosto de 2020.
Aprobado: 24 de octubre de 2020.
RESUMEN
Podocarpácea son las únicas coníferas nativas de Perú, país que contiene una de las poblaciones sudamericanas más importantes de una de sus especies miembro: Retrophyllum rospigliossi Pilger, que habita en los bosques de ceja de selva, donde sólo se conserva en pequeños relictos; debido a ello y a las dificultades para la reproducción y conservación in-situ se considera una especie vulnerable. Entre los microorganismos del suelo, los hongos micorrízicos se destacan por su actividad simbiótica al permitir una nutrición eficiente, siendo benéficos para muchas especies de árboles, proveyéndoles las condiciones necesarias para su supervivencia. El objetivo de este trabajo fue caracterizar la colonización por micorrizas de Retrophyllum rospigliossi Pilger en las categorías de Brinzal, Latizal y Fustal, y para ello se colectaron muestras en cinco parcelas georreferenciadas. Las raicillas fueron coloreadas con azul de Tripano para la observación de hifas, vesículas y arbúsculos. Las muestras de suelo fueron tamizadas para realizar el recuento de esporas. Las estructuras micorrízicas fueron encontradas en las tres categorías, con diferencias significativas para esporas y vesículas. El comportamiento de estas por gramo de suelo fue variable (hifas: 39,2 % a 53 %, esporas 30.8 % a 57,6 %, vesículas: 35 % a 51,4 %, arbúsculos: 0 al 2 %). La colonización de las raicillas osciló entre 85 % y 96,2 %. Se identificaron tres géneros micorrízicos: Glomus, Entrophospora y Acaulospora. Se concluye que, para una propagación vegetativa de especies leñosas, es necesario considerar el uso de micorrizas arbusculares para garantizar una adecuada nutrición.
Palabras clave: Micorrizas arbusculares; Brinzal; Latizal; Fustal.
ABSTRACT
Podocarpacea are the only native conifers of Peru, a country that contains one of the most important South American populations of one of its member species: Retrophyllum rospigliossi Pilger, which lives in the rainforests, where it is only preserved in small relics; due to this and the difficulties for reproduction and conservation in-situ is considered a vulnerable species. Among the microorganisms of the soil, the mycorrhizal fungi stand out for their symbiotic activity by allowing efficient nutrition, being beneficial for many species of trees, providing them with the necessary conditions for their survival. The objective of this work was to characterize the mycorrhizal colonization of Retrophyllum rospigliossi Pilger in the categories of saplings, latizal and fustal, and for this purpose, samples were collected in five georeferenced plots. The roots were colored with trypane blue for the observation of hyphae, vesicles, and shrubs. Soil samples were sifted for spore count. Mycorrhizal structures were found in all three categories, with significant differences for spores and vesicles. The behavior of these per gram of soil was variable (hyphae: 39.2 % to 53 %, spores 30.8 % to 57.6 %, vesicles: 35 % to 51.4 %, shrubs: 0 to 2 %). Colonization of roots ranged from 85 % to 96.2 %. Three mycorrhizal genera were identified: Glomus, Entrophospora and Acaulospora. It is concluded that, for a vegetative propagation of woody species, it is necessary to consider the use of arbuscular mycorrhizae to guarantee an adequate nutrition.
Keywords: Arbuscular mycorrhizae fungus; Saplings; Latizal; Fustal.
RESUMO
Podocarpácea são as únicas coníferas nativas do Perú, pais que contêm uma das populações suramericanas mais importantes duma das suas espécies membro: Retrophyllum rospigliossi Pilger, que fica nos bosques de ceja de selva, onde só se conserva em pequenos relictos; por isso, e às suas dificuldades para a reprodução e conservação in-situ, considera se uma espécie vulnerável. Entre os micro-organismos do solo, os fungos micorrízicos destacam se pela sua atividade simbiótica ao permitir uma nutrição eficiente, sendo úteis para muitas espécies de árvores, oferecendo as condições necessárias para a sua supervivência. O objetivo deste trabalho foi caracterizar a colonização por macrorrizas de Retrophyllum rospigliossi Pilger nas categorias de Brinzal, Latizal e Fustal, e para isso, coletaram se mostras em cinco parceiras geo referenciadas. As raizinhas foram coradas com azul de Tripano para observar as hifas, vesículas e arbúsculos. As mostras do solo foram tamisadas para a realização dum reconto das esporas. As estruturas micorrízicas foram achadas em três categorias, com deferências significativas para esporas e vesículas. O comportamento destas pelo gramo de solo foi variável (hifas: 39,2 % até 53 %, esporas 30.8 % até 57,6 %, vesículas: 35 % até 51,4 %, arbúsculos: 0 ao 2 %). A colonização das raizinhas oscilou entre 85 % e 96,2 %. Identificaram se três gêneros micorrízicos: Glomus, Entrophospora e Acaulospora. Se conclui que, para uma propagação vegetativa de espécies lenhosas, é necessário considerar o uso de micorrizos arbusculares para garantir uma correspondente nutrição.
Palavras chave: Micorrizos arbusculares; Brinzal; Latizal; Fustal.
INTRODUCCIÓN
La necesidad de rediseñar los modelos ecosistémicos existentes, de manera que estos permitan entender las consecuencias de las actividades humanas en el marco de la complejidad que realmente caracteriza a los ecosistemas, es un tema al que recientemente se le ha prestado mucha atención. En este sentido, es la diversidad de interacciones lo primero que se pierde en respuesta al cambio global, mucho antes de que empiecen siquiera a detectarse cambios en la biodiversidad (Ochoa, 2017).
Los bosques nublados de montaña del trópico son considerados ecosistemas muy frágiles, porque juegan un papel hidrológico y ecológico Armenteras et al., (2015) y la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO, 2016), señalan que la conversión de bosque nativo a espacios agrícolas se establece como el factor de mayor impacto sobre la mayoría de los ecosistemas terrestres, porque disminuye la superficie de hábitats naturales, constituyéndose en una amenaza para la biodiversidad. Así mismo, la remoción de la cobertura vegetal natural y el aprovechamiento desmedido de los recursos naturales han intensificado los procesos de desertificación de los suelos.
La agricultura de montaña ha logrado subsistir manteniendo prácticas ancestrales que corresponden a enfoques agroecológicos, lo que ha permitido generar una agricultura sustentable, debido a la baja dependencia de insumos externos y a la mitigación de los efectos ocasionados por la Revolución Verde en el medio ambiente, circunstancias que tienen efectos en la conservación de los suelos, el agua y la biodiversidad (Acuña y Marchant, 2016). Las técnicas agroecológicas aseguran un uso sostenible de los recursos naturales, el cuidado del ambiente y las personas, permiten que se pueda garantizar la alimentación de cada familia a largo plazo. Una de las prácticas enmarcadas dentro de este contexto es el empleo de una gran diversidad de microorganismos, dentro de los cuales están hongos y bacterias, mezclados en diferentes sustratos orgánicos para ser utilizados en la agricultura y en la ganadería (Peña et al., 2019).
Entre los microrganismos se destacan las micorrizas, que son asociaciones mutualistas entre los hongos del suelo y raíces de las plantas. En esta simbiosis, el hongo cubre sus demandas de carbono e incrementa la absorción de agua y minerales en la planta, tomando principalmente elementos de lenta difusión tales como fósforo, zinc y cobre (Bonilla y Alarcón, 2015; Medina-García, 2016; Pérez et al., 2019), favoreciendo su crecimiento y contribuyendo a la estructuración de las comunidades vegetales, la sostenibilidad, la funcionalidad y mantenimiento de ecosistemas naturales, incluyendo los degradados, siendo útiles para la naturaleza y el hombre (Garzón, 2016; Bañuelos et al., 2017; Lattuada et al., 2019).
El bosque de Huamantanga, ubicado en Jaén, Perú, es muy diverso por su tipo de vegetación, flora y fauna, y como todos los bosques, también está expuesto a la tala y cambio de uso de suelo. Dentro de las especies emblemáticas y de mayor importancia para los pobladores, por su potencial maderable, está Retrophyllum rospigliossi Pilger, conocida comúnmente como "romerillo macho"; sin embargo, su regeneración natural es escasa debido a que un alto porcentaje de semillas es atacado por insectos (coleópteros), incidiendo en una baja existencia de árboles semilleros; por otro lado, existe una alteración de su hábitat natural debido a la extracción de madera de las zonas altas de Jaén y a pesar de haberse realizado una propagación vegetativa, los resultados son mínimos, de igual manera se observa en un tipo de reproducción sexual.
La problemática antes mencionada, unido a la inexistencia de un protocolo de manejo forestal, hace que no se pueda usar R. rospigliossi Pilger en un programa de reforestación, a pesar de su alto valor económico. De ahí la importancia de conocer las características de la asociación micorrízica de esta especie vegetal en su hábitat, pues son precisamente: la presencia de hongos micorriza arbuscular (HMA) y el nivel de micorrización, dos de las variables que se tienen en cuenta para el desarrollo de técnicas culturales en programas de reforestación. Esta investigación se plantea como objetivo: Caracterizar la colonización de micorrizas en Retrophyllum rospigliossi Pilger en las categorías de Brinzal, Latizal y Fustal.
MATERIALES Y MÉTODOS
Trabajo de campo. Georreferenciación
Los lugares de muestreo se localizaron mediante imágenes satelitales, con el empleo de un drone y el software Agisoft PhotoScan, en las áreas donde se ubicaron las tres categorías de desarrollo (Brinzal, Latizal y Fustal) de los rodales de R. rospigliosii.
Se estudiaron muestras de suelo que extraídas a una profundidad de 10 a 20 cm de la rizósfera de R. rospigliosii en las categorías Brinzal (ejemplares de hasta un metro de altura), Latizal (de 8 a 20 m de atura y de 10 a 30 cm de diámetro) y Fustal (supera los 20 m de altura y entre 30 y 50 cm de diámetro). Las parcelas muestreadas se identificaron por el nombre de los caseríos más cercanos: Sport Piura (San José del Alto), Nuevo Jerusalén, Guayaquil, San Luis del Nuevo Retiro I y San Luis del Nuevo Retiro II, del distrito de Jaén, región Cajamarca, Perú (Figura 1).
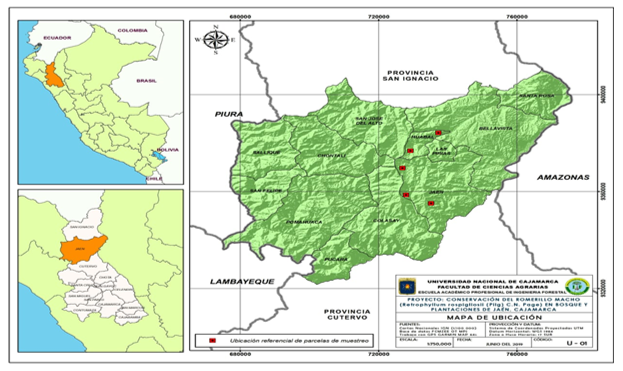
Figura 1. - Ubicación de localidades con mayor ocurrencia de las tres categorías de R. rospigliosii Pilger en la provincia de Jaén
Fuente: Universidad Nacional de Cajamarca.
Por cada lugar y categoría se tomaron tres muestras de suelo de un kg cada una, garantizando la presencia de raicillas con una longitud mínima de 1cm. Las muestras fueron procesadas antes de las 24 horas de colectadas, en caso contrario, se mantuvieron en refrigeración a 10 °C.
Trabajo de labaratorio
A. Determinación del porcentaje de colonización de raíces
Tinción de raíces
La tinción de raíces se realizó de acuerdo a la metodología propuesta por Philips y Hayman (1970) de la siguiente manera: se tomaron las raíces más finas (menores a 1 mm de diámetro), para facilitar la penetración de los reactivos. Las raíces se colocaron en placas pequeñas de vidrio para que puedan extenderse y no queden apretadas, luego se adicionó KOH al 10 % durante 30 minutos para ablandar el tejido. Seguidamente se sometió a "baño de María" (90 °C) durante 10 minutos. Las raíces fueron lavadas utilizando un tamiz adecuado para evitar pérdidas durante el enjuague. Posteriormente las muestras fueron cubiertas con una solución fresca de KOH al 10 % y H2O2 al 10 % combinado en proporción de 1:1 (V/V), por un tiempo de 15 minutos y finalmente las raíces fueron lavadas con agua corriente. Para corregir el pH se añadió una solución de HCl al 1N durante 15 minutos, luego se decantó el HCl sin lavar y se agregó el azul de Tripano al 0.05 % colocando después las raíces a "baño de María" por 15 minutos. Se retiró el colorante, se lavó con agua destilada, se dejó reposar por 12 horas para eliminar el exceso de colorante y proceder a su observación al microscopio compuesto binocular marca Olympus CX21.
Cuantificación del porcentaje de colonización
Se tomaron 10 segmentos de raíces de 1 cm de largo cada uno y se ubicaron en la lámina portaobjetos de forma paralela, se efectuó la observación de las estructuras fúngicas en el microscopio compuesto con los objetivos desde 10X hasta 40X, utilizando la técnica de determinación de colonización por campos de infección, en el cual se realizaron barridos de cada segmento de raíz. Se registró la presencia de estructuras típicas de los HMA: hifas, esporas, vesículas y arbúsculos.
Para determinar el porcentaje de colonización de cada muestra se utilizó la fórmula propuesta por Sieverding (1983) (Ecuación 1).
![]()
La frecuencia de colonización radicular se determinó considerando los segmentos colonizados y no colonizados. Se obtuvo la relación total de segmentos colonizados (aquellos en los que se detectó la presencia de arbúsculos y vesículas), con respecto a los segmentos totales evaluados. Se utilizó el mismo procedimiento para evaluar la presencia de hifas, vesículas y arbúsculos, la que fue expresada en porcentaje.
B. Densidad de esporas
Las muestras se trabajaron siguiendo la metodología propuesta por Sieverding (1983), contando las esporas que se observan en los tejidos coloreados con azul de Tripano.
C. Separación de esporas de hongos micorrízicos en suelos rizosféricos
Las muestras de suelo obtenidas en cada punto de muestreo se homogenizaron individualmente quitando todo material grueso (raíces, piedras y terrones); luego se tomaron muestras de 100 g que fueron colocadas en un vaso de precipitado de 500 ml de capacidad, agregándose 400 ml de agua destilada y se agitó por 10 minutos. Se filtró a través de un juego tamices de 4 000, 500, 250, 125 y 63 µm (ordenados verticalmente en forma descendente); se repitió el procedimiento dos veces. El contenido del tamiz de 63 µm se vertió en una placa Petri que luego se puso a secar a temperatura ambiente (28 a 30 °C).
D. Centrifugación, decantación y extracción para concentrar las esporas
De la muestra de suelo tamizado y seco, se pesó 1 g que fue depositado en tubos de centrífuga, adicionando 15 ml de solución de sacarosa al 70 %, luego se centrifugó a 2 500 rpm durante 10 minutos. Posteriormente se retiraron los tubos de la centrífuga, cuidando de no romper la interfase agua-sacarosa. Con la ayuda de una pipeta de 30 cm, se recorrió toda la superficie de la interfase, la cual se filtró en papel Watman N° 4 con ayuda de un embudo, se lavó con agua destilada para eliminar la sacarosa y se observaron las esporas en el papel de filtro; este se colocó en el microscopio compuesto, se hizo un recorrido en forma de zigzag contando las esporas utilizando los objetivos de 10X y 40X.
E. Identificación
Para la identificación de las esporas, se analizaron sus características morfológicas (forma, tamaño, color, textura de la superficie, tipo de hifa de soporte y procedencia); para lo cual se colocaron en láminas portaobjetos que tenían en el centro una cuadricula con divisiones igual a 0,01 mm. Se observaron con el objetivo de 40X en el microscopio compuesto binocular marca Olympus CX21. La descripción de las esporas se utilizó en la identificación taxonómica hasta el nivel de género con el apoyo de claves y descripciones actualizadas por Guerrero y Hodson (1988).
F. Análisis estadístico
A los datos obtenidos, una vez comprobado que cumplían los supuestos de normalidad, se les aplicó el análisis de varianza (ANOVA) para determinar la presencia de diferencias estadísticas entre los porcentajes de colonización y para cada uno de los porcentajes de las estructuras fúngicas observadas (hifas, esporas, vesículas, arbúsculos). En cada caso se realizaron dos ANOVA, uno para comparar los resultados entre las parcelas muestreadas y otro para la comparación entre los estados de desarrollo. En los casos en que se detectó diferencia significativa (P ˂ 0,05), se aplicó la prueba T para comparar por pares de elementos (parcelas o estado de desarrollo), a partir de todas las combinaciones posibles, con el propósito de determinar, según el caso, entre qué parcelas o estados del desarrollo se encontraba dicha diferencia. En todos los casos se empleó el programa estadístico SPSS versión 26.0.
RESULTADOS Y DISCUSIÓN
El estudio de las diferentes estructuras de HMA en la rizósfera de R. rospigliosii, donde la biomasa microbiana es hasta 10 veces mayor que en el suelo (Bonilla y Alarcón, 2015), evidenció la presencia de hifas, esporas, vesículas y arbúsculos en las tres categorías analizadas.
El porcentaje de hifas encontrado en las tres categorías evaluadas (Figura 2), no arrojó diferencias significativas (P ≥ 0,05).
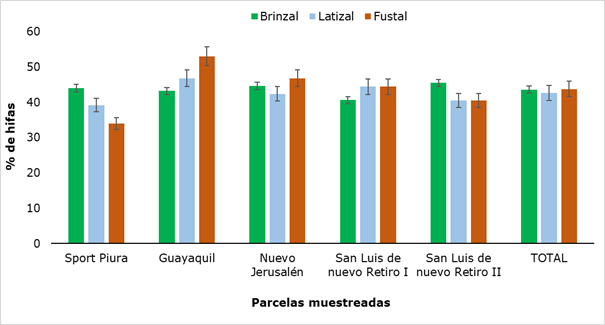
Figura 2. - Porcentaje de hifas de R. rospigliosii presentes en las diferentes categorías
La presencia de hifas osciló entre 34 % y 53 %, ambos valores obtenidos en árboles adultos. Resultados similares fueron informados por Gómez (2019), al realizar el estudio de micorrizas arbusculares en tres sistemas de uso de suelo, determinando un porcentaje de colonización por hifas de un 66% a partir de muestras tomadas a una profundidad de 10 cm. Se infiere así, que la presencia de hifas en todos los sectores y las leves variaciones entre los lugares, puede ser debido al tipo de suelo, pues el bosque Huamantanga presenta una textura muy variada, encontrándose entre franco arenoso hasta arcilloso (UNC, 2019).
La presencia de hifas de diferente grosor encontradas en las raicillas de la rizósfera de R. rospigliosii (Figura 3) se clasificaron como tipo París y Arum, con formación de suficientes rulos de los cuales se originan los arbúsculos, y presentar hifas intercelulares y arbúsculos intracelulares. Los resultados obtenidos son similares a los de Parra-Rivero et al. (2018) al presentar los tipos de hifa presentes en la colonización por HMA de los sistemas radicales de dos leguminosas arbóreas, observando dos tipos morfológicos simultáneos: Arum y Paris, siendo la primera de mayor frecuencia con hifas gruesas con estructura en H, que recorren paralelos a la superficie radical de manera intercelular y forma arbúsculos laterales intracelulares; la segunda, es de hifa gruesa intracelular que forman circunvoluciones.

Figura 3. - Hifas coloreadas con azul de Tripano, observada a 40X
La presencia de hifas Paris y Arum en la colonización micorrízica arbuscular, está determinada por la interacción entre el genotipo de la planta y el genotipo del hongo micorrízico de la planta hospedante, sin embargo, el establecimiento de la asociación micorrízica en condiciones naturales puede considerarse como multicausal (Santillana y Toro, 2018). Otros autores mencionan que, siguiendo la clasificación de los tipos de colonización de HMA propuesta, corresponde al tipo denominado Intermedite I, el que se caracteriza por la presencia de arbúsculos intracelulares formados a partir de hifas intercelulares e hifas intracelulares informando por primera vez la presencia de esta relación en los bosques templados del hemisferio sur, de esta manera se valora que las hifas encontradas en la presente investigación, son características correspondientes a una micorriza arbúscula (Cottet y Messuti, 2017).
La densidad de esporas encontradas después del tamizaje de los suelos se muestra en la Figura 4, en la que se puede apreciar que la menor cantidad de esporas se obtuvo en la categoría Brinzal en la parcela Guayaquil (30.8 %) y el valor máximo se obtuvo en este mismo lugar de muestreo en la categoría Fustal (57.6 %), encontrándose una diferencia significativa estadísticamente al comparar los resultados entre las tres categorías analizadas, precisamente entre Brinzal y Fustal.
Los valores obtenidos difieren cuantitativamente de los resultados informados por Peña y López (2018), quienes al evaluar la presencia de esporas de hongos micorrízicos arbusculares en cinco estados sucesionales del bosque altoandino colombiano detectaron entre 4 y 20 esporas g-1; sin embargo, los mayores valores en el número de esporas fueron encontrados en el estado sucesional maduro, lo que corrobora el valor máximo obtenido en la categoría Fustal de la presente investigación.
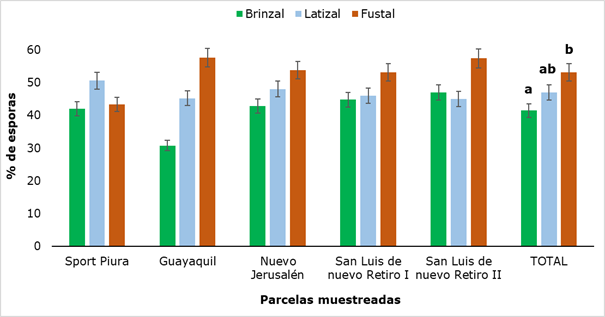
Figura 4. - Porentaje de esporas en suelo rizosférico de R. rospigliosii
Letras diferentes muestran
que hubo diferencias significativas (P ˂ 0,05) entre los estados de desarrollo analizados.
Las esporas micorrízicas del suelo son las más grandes (entre 145 y 800 µm), con colores que varían desde el hialino y amarillo pálido hasta el marrón, rojizo y negro. Las paredes de las esporas (lisas u ornamentadas), el tamaño y la ontogenia de las esporas, forman una base para la identificación de estos hongos. Estas características son de gran utilidad para la identificación taxonómica de los HMA, lo que permitió en esta investigación identificar tres géneros de HMA: Glomus, Entrophosora y Acaulospora, tal y como se observa en la Figura 5.
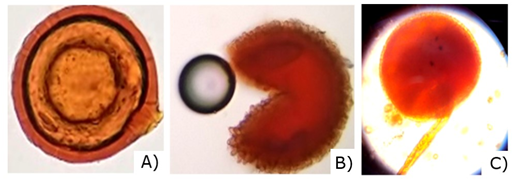
Figura 5. - Esporas encontradas en la rizósfera de R. rospigliosii Pilger. A) Glomus sp., B) Entrophosora sp., C) Acaulospora sp
Al evaluar la presencia de vesículas en las raicillas (Figura 6) se encontró que esta estructura estaba presente en todas las parcelas muestreadas y los valores oscilaron entre 35 % (categoría Fustal en Guayaquil) y 51,4 % (categoría Brinzal en Sport Piura). De manera general, los mayores valores se encontraron en la categoría Brinzal, la que mostró diferencia significativa con la categoría Latizal. Resultados similares fueron encontrados por García et al., (2004) en una investigación con ocho especies forestales en la selva altoandina, informando valores máximos de 51,7 % de vesículas.
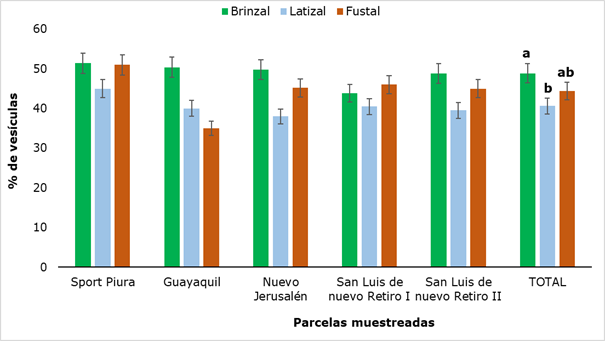
Figura 6. - Porcentaje de vesículas presentes en suelo rizosférico de R. rospigliosii
Letras diferentes muestran que hubo diferencias significativas (P
˂ 0,05) entre los estados de desarrollo analizados.
Estas porciones de hifas (vesículas) que forman algunos géneros de HMA, se encuentran presentes intercelularmente en la corteza de la raíz y se consideran reservorios de nutrientes para el hongo (Figura 7). Esta simbiosis entre el HMA y la planta se conoce como vesículo-arbuscular (VA) por la presencia de vesículas y arbúsculos; como no todas las especies de hongos desarrollan vesículas, en la actualidad se les conoce como micorriza arbuscular (Camarena-Gutiérrez, 2012).
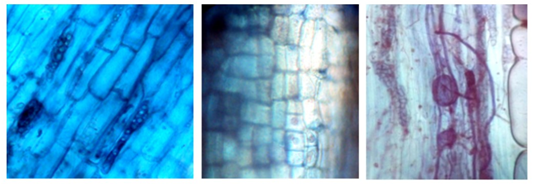
Figura 7. - Vesículas en la categoría Brinzal coloreado con azul de Tripano en R. rospigliosii, observadas a 40X
El proceso de infección o colonización ocurre inicialmente con el crecimiento del hongo en el suelo y el contacto físico con la raíz. Entonces, ocurre un intercambio de información que permite que el hongo crezca entre las células de la raíz y colonice el tejido vegetal. En algunos lugares, la hifa ingresa a la pared celular y se divide intensamente, pero no rompe la membrana plasmática. Esta estructura ramificada es denominada arbúsculo y se reconoce como un órgano de intercambio de metabolismo entre parejas (Ortiz-Acevedo et al., 2015).
El comportamiento de la presencia de arbúsculos, en las valoraciones expuestas en la presente investigación, fue diferente al de las otras estructuras analizadas (hifas, esporas y vesículas), pues no se detectó en todas las parcelas, y en algunas no se registró en las tres categorías evaluadas (Figura 8).
Como puede apreciarse en la Figura 8, en San Luis de Nuevo Retiro II no se encontraron arbúsculos y en San Luis de Nuevo Retiro I sí se detectaron, en las tres categorías evaluadas. En el resto de las parcelas muestreadas hay presencia de arbúsculos, pero no en todas las categorías, de ahí que se aprecien diferencias estadísticamente significativas entre los resultados obtenidos para cada sitio de muestro. Los valores oscilaron entre un mínimo de 0,6 % y un máximo de 2,0 %, el primero en las categorías de Latizal y Fustal y el segundo en la categoría Brinzal. En la Figura 9, se muestran algunos arbúsculos encontrados en esta última categoría.
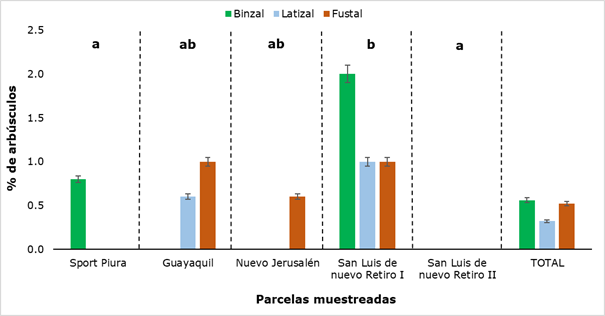
Figura 8. - Porcentaje de arbúsculos detectados en los diferentes sectores y categorías de R. rospigliosii
Letras diferentes muestran diferencias significativas
(P ˂ 0,05) entre las parcelas muestreadas.
Los resultados evidencian un bajo porcentaje de arbúsculos, al compararlos con otras investigaciones, como las realizadas por Parra-Rivero et al., (2018) y Rivera et al., (2016), quienes informan valores altos para esta estructura (entre 31 % y 90 %), al estudiar la colonización de HMA en plantas arbóreas. Esta diferencia en la presencia de estructuras colonizantes tipo arbúsculos, puede deberse a que estos tienen una vida efímera (4-15 días) y siempre terminan por ser digeridos por la planta hospedadora (Rivera et al., 2016; Pérez et al., 2016).
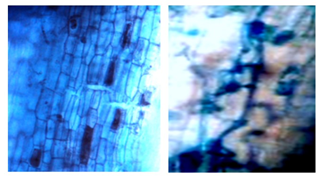
Figura 9. - Arbúsculos en la categoria brinzal coloreado con azul de Tripano a 40x
Los resultados de la colonización por HMA en Retrophyllum rospigliosii Pilger se muestran en la Figura 10, en la que se puede apreciar que el valor mínimo obtenido fue de 85 % (Fustal) y el máximo fue de 96,2 % (Brinzal).
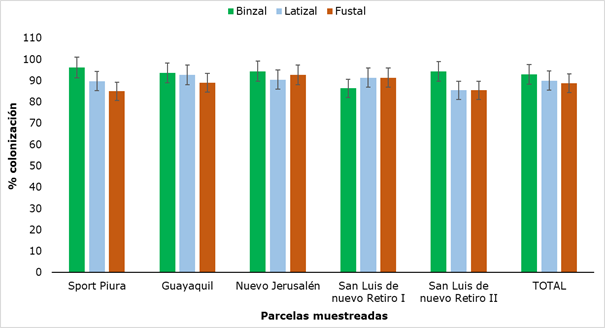
Figura 10. - Colonización de HMA en los diferentes sectores y categorías de R. rospigliosii
Los valores obtenidos para la colonización no mostraron diferencias significativas al analizar las parcelas muestreadas ni al comparar las tres categorías. Si bien estos valores no tienen un patrón estandarizado de comparación, pues la variabilidad de la colonización micorrízica está asociada al tipo de especie vegetal y su edad fisiológica (Belezaca et al., 2020), si constituyen valores muy altos de colonización, lo que unido a la presencia de las estructuras micorrízicas en todas las categorías, permite afirmar que hay cierto grado de dependencia entre la planta y el HMA, elemento de gran importancia debido a que, en la simbiosis micorrízica, el hongo permite el incremento en la adquisición de nutrientes, principalmente de aquellos de escasa movilidad en el suelo, como el fósforo, al mismo tiempo que la planta proporciona compuestos carbonados para el crecimiento del hongo (Flores y Cuenca, 2004).
Este elemento cobra mayor importancia en la presente investigación porque en el bosque de Humantanga, según lo informado por UNC (2019), el fósforo se encuentra en un nivel bajo (8,11 ppm), teniendo en cuenta los rangos interpretativos mencionados por Andrades y Martínez (2014). En este caso, la actividad fúngica asociada a la planta genera un sistema de beneficio mutuo, pues los HMA modifican la morfología de las raicillas, dándole a la planta una mejor capacidad para alcanzar el agua y disolver los nutrientes, pudiendo resolver el problema del agotamiento inminente del stock de fosfato y otros elementos como, nitrógeno, zinc, cobre, hierro, potasio, calcio y magnesio (en algunos casos los nutrientes pueden controlar el desarrollo o iniciar la simbiosis), también puede causar un cambio en la absorción de más nutrientes al mismo tiempo y permiten la inducción de las defensas del hospedero para mejorar la nutrición (Uc et al., 2019; Piliarova et al., 2019).
CONCLUSIONES
En todas las categorías de crecimiento de los rodales de Retrophyllum rospigliosii Pilger analizadas en la investigación, se encontraron estructuras típicas de los HMA (hifas, esporas, vesículas y arbúsculos), lo que indica que este es una especie vegetal que hace simbiosis con micorrizas arbusculares.
Los géneros de hongos determinados en las tres categorías Brinsal, Latizal y Fustal de R. rospigliosii Pilger, según la morfología de las esporas, corresponden a Glomus, Entrophospora y Acaulospora.
Los altos porcientos de colonización de los HMA en R. rospigliosii Pilger y su presencia en las tres categorías de desarrollo, permiten afirmar que esta relación simbiótica es importante en el desarrollo del romerillo macho en el bosque de Huamantanga, garantizando una buena absorción de fósforo, además de los otros beneficios que derivan de esta interacción hongo-planta.
Estos resultados contribuyen al conocimiento de esta colonización micorrízica, lo que permite valorar el empleo de los HMA en el desarrollo de técnicas culturales en programas de reforestación de R. rospigliosii Pilger, especie forestal declarada como especie vulnerable.
AGRADECIMIENTOS
Los autores expresamos un especial agradecimiento al Centro de Estudios para el Perfeccionamiento de la Educación Superior (CEPES), de la Universidad de La Habana, Cuba y a la Consultora Educativa Especializada (CEES) de Perú, por la asesoría brindada en la elaboración del presente artículo científico.
REFERENCIAS BIBLIOGRÁFICAS
ACUÑA, N.R. y MARCHANT, C., 2016. ¿Contribuyen las prácticas agroecológicas a la sustentabilidad de la agricultura familiar de montaña? El caso de Curarrehue, región de la Araucanía, Chile. En: Cuadernos de Desarrollo Rural, vol. 13. Bogotá: Pontificia Universidad Javeriana. Núm. 78, julio-diciembre, pp. 35-66. ISSN: 0122-1450. Disponible en: http://www.redalyc.org/articulo.oa?id=11753256002
ANDRADES, M. y MARTÍNEZ, M.E., 2014. Fertilidad del suelo y parámetros que la definen. 3ra ed. Logroño: Universidad de la Rioja, Servicio de Publicaciones, 29p. ISBN 978-84-695-9286-1. Disponible en: https://dialnet.unirioja.es/servlet/libro?codigo=267902
ARMENTERAS, D., GONZÁLEZ, T.M., VERGARA, L.K., LUQUE, F.J., RODRÍGUEZ, N., BONILLA, M.A., 2015. Revisión del concepto de ecosistema como "unidad de la naturaleza" 80 años después de su formulación. En: Ecosistemas, vol. 25 No.1, pp. 83-89. Disponible en: https://doi.org/10.7818/ECOS.2016.25-1.12
BAÑUELOS, J., SANGABRIEL, W., GAVITO, M.E., TREJO, D. CAMARA, S., MEDEL, R. y CARREON, J., 2017. Efecto de diferentes niveles de fósforo en aguacate inoculado con hongos micorrízicos arbusculares. En: Revista Mexicana de Ciencias Agrícolas, Vol. 8, Núm. 7, pp: 1509-1520. Disponible en: http://www.scielo.org.mx/pdf/remexca/v8n7/2007-0934-remexca-8-07 -1509.pdf
BELEZACA, C., CALLE, D., PRIETO, O., LÓPEZ, R., SOLANO, E., DÍAZ, O., DÍAZ, P., GUACHAMBALA, M., BOHÓRQUEZ, T., 2020. Hongos de micorriza arbuscular presentes en Ochroma pyramidale (Cav. ex Lam.) Urb. (Balsa) en Ecuador. Journal of Science and Research, Vol. 5, Nº 3, pp: 1-14. E-ISSN: 2528-8083. Disponible en: https://revistas.utb.edu.ec/index.php/sr/article/view/899
BONILLA, J.A. y ALARCÓN, J.A., 2015. Turnos técnico y económico de tala para árboles de Romerillo blanco en Ecuador. Ecología Aplicada, vol. 14 no. 2, pp. 127137. Disponible en: http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1726-22162015000200005
CAMARENA-GUTIÉRREZ, G., 2012. Interacción planta-hongos micorrízicos arbusculares. Revista Chapingo Serie Ciencias Forestales y del Ambiente, Vol. XVIII, Núm. 3, pp. 409-421. DOI: Disponible en: http://dx.doi.org/10.5154/r.rchscfa.2011.11.093
COTTET, A.C. y MESSUTI, M.I., 2017. Identificación del tipo morfológico de micorriza arbuscular en Phaeoceros laevis (Anthocerotophyta). Bol. Soc. Argent. Bot, Vol. 52 No. 2. pp. 291-293. Disponible en: https://botanicaargentina.org.ar/wp-content/uploads/2017/06/08_cottet.pdf
FAO, 2016. El estado de los bosques del mundo. Los bosques y la agricultura: desafíos y oportunidades en relación con el uso de la tierra. Organización de las Naciones Unidas para la Alimentación y la Agricultura, Roma, 137p. ISBN 978-92-5-309-208-6. Disponible en: http://www.fao.org/3/a-i5588s.pdf
FLORES, C. y CUENCA, G., 2004. Crecimiento y dependencia micorrízica de la especie pionera y polenectarífera Oyedaea verbesinoides (Tara amarilla), Asteraceae. En: Interciencia, vol. 29, no. 11, pp. 632-637. Disponible en: http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0378-18442004001100007
GARCÍA, J.F., GARCÍA, D.C. y CORREA, M., 2004. Incidencia de las micorrizas arbusculares y vesículo arbusculares como estrategia adaptativa de especies de páramo y selva altoandina, cordillera oriental de Colombia. Colombia Forestal, Vol. 8, Núm. 17, pp: 43-59. Disponible en: https://doi.org/10.14483/udistrital.jour.colomb.for.2004.1.a03
GARZÓN, L.P., 2016. Importancia de las Micorrizas Arbusculares (Ma) para un uso sostenible del suelo en la amazonia colombiana. Luna Azul, vol. no. 42, pp: 217-234. Disponible en: https://doi.org/10.17151/luaz.2016.42.14
GUERRERO, E. y HODSON, E., 1988. Micorrizas en Decussocarpus rospigliossi (Pilger) de Laubenfels, una Podocarpacea del bosque andino. En: Universitas Scientiarum, vol. no.1, pp. 53-66. Disponible en: http://revistas.javeriana.edu.co/index.php/scientarium/article/view/5091
LATTUADA, D.S., RIETH, S., BACK, M.M. y DE SOUZA, P.V.D., 2019. Interaction between endomycorrhizae and native fruit tree (myrtaceae) in Rio Grande do Sul state. Ciencia Florestal, vol 29 no. 4, pp: 1726-1736. Disponible en: https://doi.org/10.5902/1980509837389
MEDINA-GARCÍA, L.R., 2016. La agricultura, la salinidad y los hongos micorrízicos arbusculares‰§ una necesidad, un problema y una alternativa. Revista Cultivos Tropicales, Vol. 37, Núm. 3, pp: 42-49. Disponible en: http://dx.doi.org/10.13140/RG.2.1.1117.9765
OCHOA, R., 2017. Consecuencias de la deposición de nitrógeno sobre la biodiversidad y el funcionamiento de los ecosistemas terrestres: una aproximación general desde la ecología de los sistemas. Revista Ecosistemas, vol. 26 No.1, pp: 25-36. ISSN 1697-2473. Disponible en: http://doi.org/10.7818/ecos.2017.26-1.05
ORTIZ-ACEVEDO, A., OSORIO-VEGA, N.W., ECHEVERRI-GÓMEZ, J., GONZÁLEZ-MURILLO, O.A. Y MEDINA-SIERRA, M., 2015. Fisiología de los hongos formadores de micorrizas arbusculares. En: Livestock Research for Rural Development, Vol. 27, Núm. 9, paper 188. Disponible en: http://www.lrrd.org/lrrd27/9/orti27188.html
PARRA-RIVERO, S.M., MACIEL-DE SOUSA, N.M., SANABRIA-CHOPITE, M. Y PINEDA, J., 2018. Descripción anatómica de la colonización de hongos micorrízicos arbusculares en dos leguminosas arbóreas. En: Revista Chapingo Serie Ciencias Forestales y del Ambiente, Vol.24, Núm. 2, pp. 183-196. DOI: Disponible en: http://dx.doi.org/10.5154/r.rchscfa.2017.02.014
PEÑA, A., ROJAS, M., MILÁN, E., GUERRERO, N. y ARIAS, H., 2019. Implementación de las técnicas agroecológicas de microorganismos eficientes y bioplaguicida en finca de productores. Talle Uso y manejos sostenibles de ecosistemas agrícolas, 9na. Conferencia Científica Internacional de la Universidad de Holguín, Cuba. Disponible en: https://eventos.uho.edu.cu/index.php/ccm/ccm9/paper/view/4092
PEÑA, D.Y. y LÓPEZ, F., 2018. Presencia de esporas de hongos micorrízico arbusculares en cinco estados sucesionales de bosque altoandino colombiano. En: Revista de Investigación Agraria y Ambiental, Vol. 9, Núm. 2, pp: 135-148. DOI: Disponible en: https://doi.org/10.22490/21456453.2194
PÉREZ, A., CURY, K. y OVIEDO, L., 2016. Colonización de micorrizas arbusculares en tres especies de pasturas del departamento de Sucre. En: Temas Agrarios, 21(2), pp: 65-75. Disponible en: https://doi.org/10.21897/rta.v21i2.902
PÉREZ, Y. DEL C., ÁLVAREZ, P. E., GONZÁLEZ, D. y MÉNDEZ, V., 2019. Evaluación de la presencia de hongos micorrízico arbusculares en un bosque de pino-encino en Chiapas, México. En: Idesia, vol. 37, n. 1, pp. 67-73. Disponible en: http://dx.doi.org/10.4067/S0718-34292019005000401
PHILIPS, J.M. y HAYMAN, D.S., 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. En: Transactions of the British Mycological Society, Vol.55, No.1, pp. 158-161. Disponible en: https://doi.org/10.1016/S0007-1536(70)80110-3
PILIAROVÁ, M., ONDREIÈKOVÁ, K., HUDCOVICOVÁ, M., MIHÁLIK, D., KRAIC, J., 2019. Arbuscular mycorrhizal fungi their life and function in ecosystem. Agriculture (Polnohospodárstvo), Research Institute of Plant Production, Slovakia, vol. 65, no. 1, pp. 315. Disponible en: http://doi.org/10.2478/agri-2019-0001
RIVERA, F.A., GONZÁLEZ, V., GONZÁLEZ, J.G. y OSSA, P.A., 2016. Caracterización molecular, análisis morfológico y colonización micorrízica en la rizósfera del aguacate (Persea americana Mill) en Caldas, Colombia. Revista Acta Agronómica, Vol. 65, Núm. 4, pp. 398-405. DOI: Disponible en: https://doi.org/10.15446/acag.v65n4.51714
SANTILLANA, N. y TORO, M., 2018. Asociación micorrízica arbuscular en pastizales de la comunidad alto andina de Ccarhuaccpampa Ayacucho. Revista Ecología Aplicada, Vol. 17, Núm. 2, pp: 165-169. Disponible en: http://dx.doi.org/10.21704/rea.v17i2.1236
SIEVERDING, E., 1983. Manual de métodos para la investigación de la micorriza vesículo-arbuscular en el laboratorio. Centro Internacional de Agricultura Tropical, Cali, Colombia. Disponible en: https://es.scribd.com/document/270011075/Manual-de-Metodos-Para-La -Investigacion-de-La-Micorriza-Vesiculo-Arbuscular-en-El-Laboratorio
UC, A.G., ARREOLA, J., CARRILLO, E., OSNAYA, M.M., ALARCÓN, A., FERRERA, R. Y LANDEROS, C., 2019. Inoculación de hongos micorrízicos arbusculares en el cultivo de Heliconia stricta. Revista Mexicana de Ciencias Agrícolas, vol. 10 No. 5, pp. 1057-1069. Disponible en: https://doi.org/10.29312/remexca.v10i5.1608
UNC, 2019. Proyecto Conservación del Romerillo macho Retrophyllum rospigliossi en bosques y plantaciones de Jaén, Perú. Informe final de resultados presentados a la Unidad de Investigación, Universidad Nacional de Cajamarca.
Conflicto de intereses:
Los autores declaran no tener conflictos de intereses.
Contribución de los autores:
Los autores han participado en la redacción del trabajo y análisis de los documentos.
![]()
Esta obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial
4.0 Internacional.
Copyright (c) 2020 Marcela Nancy Arteaga Cuba, Segundo Medardo Tafur Santillán, Germán Pérez Hurtado, Sigilberto Antonio Pastor Ordinola, Amado Batista Mainegra