
Influencia de sustratos y concentraciones de ácido indol butírico en la propagación vegetativa de Cinchona officinalis L. (quina) en Amazonas, Perú
Influence of substrates and indol butyric acid concentrations on the vegetative propagation of Cinchona officinalis L. (quina) in Amazonia, Peru
Influência dos substratos e das concentrações de ácido butírico indol na propagação vegetativa de Cinchona officinalis L. (cinchona) na Amazónia, Peru
Tito Sánchez
Santillán1* ![]() https://orcid.org/0000-0002-3352-341X
https://orcid.org/0000-0002-3352-341X
Gelver Silva Valqui2 ![]() https://orcid.org/0000-0002-1471-1810
https://orcid.org/0000-0002-1471-1810
Ariel Kedy Chichipe Puscan1 ![]() https://orcid.org/0000-0003-3298-2961
https://orcid.org/0000-0003-3298-2961
Marcial Trigoso Pinedo1
![]() https://orcid.org/0000-0001-5007-4049
https://orcid.org/0000-0001-5007-4049
Leidy Gheraldinne Bobadilla
Rivera2 ![]() https://orcid.org/0000-0002-9873-1252
https://orcid.org/0000-0002-9873-1252
Geidy Yecenia Jiménez
Yoplac1 ![]() https://orcid.org/0000-0001-8897-1765
https://orcid.org/0000-0001-8897-1765
1Instituto de Investigaciones de la Amazonia Peruana, Perú.
2Instituto Nacional de Innovación Agraria, Perú.
*Autor para la correspondencia: titosanchezsantillan@gmail.com
Recibido: 5 de marzo de 2020.
Aprobado: 16 de abril de 2020.
RESUMEN
La investigación tiene por objetivo evaluar la influencia de sustratos y concentraciones de ácido indol butírico (AIB) en la propagación vegetativa de Cinchona officinalis L. (quina) en Amazonas, Perú. Se utilizó un diseño completo al azar con arreglo factorial, de 3A x 4B, dónde factor A: sustratos (arena, arena 50 % + turba 50 % y turba) y factor B: concentración de AIB (0, 1, 2, 3 g.L-1). El trabajo se desarrolló en dos fases, en campo se colectaron ramas ortotrópicas juveniles de árboles plus del bosque de neblina San Jerónimo en Perú, ubicado a 2616 metros sobre el nivel del mar. La fase de vivero, se desarrolló en el centro experimental de la Universidad Nacional Toribio Rodríguez de Mendoza-Amazonas. Las ramas juveniles colectados de campo fueron uniformizados a 7 cm, dejando dos hojas con 50 % de área, se desinfectaron con fungicida Propineb 70 % 3 g.L-1 de agua. Se encontró que los sustratos influyeron significativamente, sobresaliendo el sustrato arena en la sobrevivencia y arena+turba mostró superioridad en el enraizamiento, número y longitud de raíces. Concentraciones de 2 y 3 g.L-1 de AIB, estimularon la emisión radicular e incrementaron el número y tamaño de raíces. Los sustratos y concentraciones de AIB influyeron positivamente en el enraizado de ramas juveniles de C. officinalis en condiciones ambientales controladas.
Palabras clave: Cinchona officinalis; Auxina; Enraizamiento; Juvenil; Ramas; Sobrevivencia.
ABSTRACT
The research aims to evaluate the influence of substrates and concentrations of indol butyric acid (AIB) on the vegetative propagation of Cinchona officinalis L. (quina) in Amazonas, Peru. A complete randomized factorial design of 3A x 4B was used, where factor A: substrates (sand, sand 50 % + peat 50 % and peat) and factor B: AIB concentration (0, 1, 2, 3 g.L-1). The study was developed in two phases. In the field, juvenile orthotropic branches of plus trees were collected from the San Jerónimo cloud forest in Peru, located at 2616 meters above sea level. The nursery phase was developed in the experimental center of the National University Toribio Rodriguez of Mendoza-Amazon. The juvenile branches collected from the field were uniformed to 7 cm, leaving two leaves with 50 % of area, were disinfected with Propineb 70 % fungicide 3 g.L-1 of water. It was found that substrates influenced significantly, standing out the sand substrate in the survival and sand + peat showed superiority in rooting, number and length of roots. Concentrations of 2 and 3 g.L-1 of AIB, stimulated root emission and increased the number and size of roots. Substrates and AIB concentrations positively influenced the rooting of young branches of C. officinalis under controlled environmental conditions.
Keywords: Cinchona officinalis; Auxina, Rooting; Juvenile branches; Propagation.
RESUMO
A investigação visa avaliar a influência dos substratos e concentrações de ácido indol butírico (AIB) na propagação vegetativa de Cinchona officinalis L. (cinchona) no Amazonas, Peru. Foi utilizado um desenho fatorial randomizado completo de 3A x 4B, em que o fator A: substratos (areia, areia 50 % + turfa 50 % e turfa) e o fator B: concentração AIB (0, 1, 2, 3 g.L-1). O trabalho foi desenvolvido em duas fases. No campo, foram recolhidos ramos ortótropos juvenis de mais árvores da floresta nublada de San Jerónimo, no Peru, localizada a 2616 metros acima do nível do mar. A fase de viveiro foi desenvolvida no centro experimental da Universidade Nacional Toribio Rodriguez de Mendoza-Amazónia. Os ramos juvenis recolhidos no campo foram uniformizados até 7 cm, deixando duas folhas com 50 % de área, foram desinfetados com o fungicida Propineb 70 % 3 g.L-1 de água. Verificou-se que os substratos influenciaram significativamente, destacando-se o substrato de areia na sobrevivência e a areia + turfa mostrou superioridade no enraizamento, número e comprimento das raízes. Concentrações de 2 e 3 g.L-1 de AIB, estimulação da emissão radicular e aumento do número e dimensão das raízes. Substratos e concentrações de AIB influenciaram positivamente o enraizamento de ramos jovens de C. officinalis em condições ambientais controladas.
Palavras-chave: Cinchona officinalis; Auxina; Enraizamento; Juvenil; Ramos; sobrevivência.
INTRODUCCIÓN
Cinchona officinalis L., conocida como árbol de quina o cascarilla, pertenece a la familia Rubiaceae, originaria de la zona Andina suramericana y distribuida desde Bolivia, Perú, Ecuador, Colombia y Venezuela (Gómez et al., 2016; Barrutia et al., 2020). Es una planta medicinal, que ha sido utilizado en tratamientos de la malaria o paludismo salvando muchas vidas humanas a nivel mundial (Álvarez, 2013).
En el Perú, la quina es considerado un símbolo nacional, así mismo aparece en el escudo nacional (Álvarez, 2013), sin embargo, existe un gran desconocimiento por parte de la población acerca del nivel de riesgo del mismo, ya que con la necesidad de desarrollar una agricultura y/o ganadería, deforestan grandes cantidades de bosques naturales, dentro de ellos plantas de quina (Castañeda et al., 2019).
Según información de medios periodísticos, dentro del género Chinchona en el Perú existen 19 especies, los cuales aún no se encuentran registrados en su totalidad en inventarios nacionales (RPP, 2017). En la región Amazonas, se pueden encontrar algunas poblaciones de C. officinalis, principalmente en las provincias de Luya (San Jerónimo), Condorcanqui, Bagua, Rodríguez de Mendoza, Bongará (Progreso, Yambrasbamba) (Castañeda et al., 2019), situados generalmente en bosques nubosos (Carguay-Yaguana et al., 2016).
El problema principal en la especie (quina), es la propagación, si bien la semilla botánica es una alternativa estas han reportado bajas tasas de germinación (Buddenhagen et al., 2004). No obstante, existe otro método de propagación más rápido y sencillo, la asexual mediante la utilización de tejidos vegetales (Osuna et al. 2016). Al respecto, Conde et al., (2017) obtuvieron resultados exitosos mediante el enraizamiento de brotes juveniles de quina (mayores al 90 %) con aplicaciones de auxinas.
En base a lo descrito y con el fin de encontrar una metodología eficiente, para la propagación, el presente trabajo pretende evaluar la influencia de sustratos y concentraciones de AIB en la propagación vegetativa de C. officinalis L. (quina) en Amazonas, Perú.
MATERIALES Y MÉTODOS
Ubicación de la investigación
Fase de campo
Las plantas madres fueron seleccionados en el área protegida del bosque de neblina en el distrito San Jerónimo-Perú, con coordenadas latitud 5° 59' 59,2" Sur, y longitud 72° 01' 14" Oeste, a una altitud 2 616 m.s.n.m.
En campo se tomaron muestras de hojas, flores, frutos y semillas, las mismas que fueron caracterizados y contrastados dendrométricamente siguiendo la metodología de Huamán et al., (2019). Las muestras de quina procedentes de San Jerónimo se conservaron en el herbario del Laboratorio de Dendrología en la Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas.
Fase de vivero
El proceso de enraizamiento se realizó en el centro experimental de la Universidad Nacional Toribio Rodríguez de Mendoza, en los ambientes de vivero construidos por el Instituto de Investigaciones de la Amazonia Peruana localizado a 6° 25' 39" latitud Sur y a 77° 32' 13" longitud Oeste a una altitud 1 714 m.s.n.m.
Selección y colecta del material vegetal
Se seleccionaron diez árboles plus de 8 a 10 metros de altura con DAP de 25 cm. Con ayuda de una tijera telescópica, se cortaron ramas ortotrópicas juveniles. Para garantizar el éxito en el enraizado Danaxa et al., (2012) sugieren colectar material de tejido juvenil ya que estas responden mejor a los reguladores de crecimiento. Los brotes colectados fueron envueltos en papel craft, se codificaron y colocaron en una caja de tecnopor, previamente humedecidas para mantener las ramas turgentes (Vásquez et al., 2018), durante el traslado al centro experimental.
Instalación del experimento
En el centro experimental, se construyó una cámara de subirrigación con dimensiones de 3,60 x 1,20 x 0,90 m, de largo, ancho y altura respectivamente, se acondicionó un sistema de riego automatizado, para regular la temperatura entre 18 y 30 °C y humedad relativa mayor al 80 %. Se programó un riego por día por un minuto.
En laboratorio se desinfectaron los brotes con fungicida Propineb 70 % PM, a concentración 3 g.L-1 de agua, dejando los brotes en la solución por 3 minutos (Inuma et al., 2018).
El material vegetal desinfectado se cortó uniformemente a 7 cm, dejando un par de hojas cortadas al 50 % del área foliar, en la base de la estaca se realizó un corte en bisel. Para el tratamiento con auxina, se tuvo en cuenta, al momento del corte de la base del brote, se retiró el exceso de savia que emanaban con un papel toalla por 60 segundos. Se colocaron en solución de AIB a diferentes concentraciones, diluido en alcohol 90° por 20 segundos (Torres et al., 2014). Se dejaron los brotes sobre papel por 10 minutos a una temperatura de 20°C, para la absorción de la auxina. Se utilizó sustratos, arena 100 %, arena 50 % + turba 50 % y turba 100 %, se desinfectaron, y depositaron en bandejas de polietileno de 40 x 30 x 10 cm.
Diseño experimental
El experimento se instaló bajo un diseño completo al azar con arreglo factorial de 3A x 4B, dando 12 tratamientos, 3 repeticiones y 36 unidades experimentales (Tabla 1).
Tabla 1. - Descripción de factores y tratamientos aplicados a C. officinalis
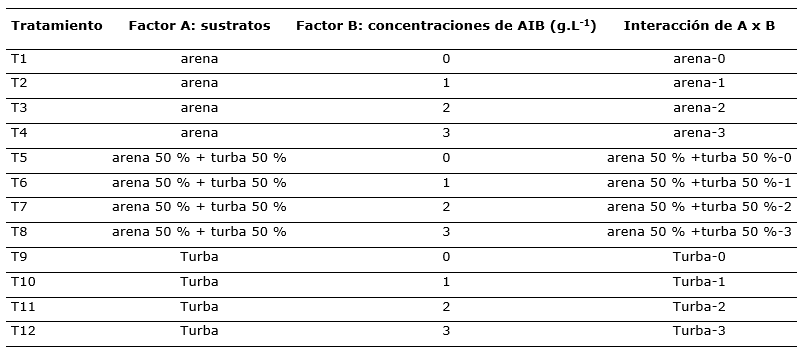
Evaluación de variables
Sobrevivencia de ramas juveniles: se contabilizaron ramas vivas a los 60 días, luego fueron pasados a un formato digital Excel para transformarlos a porcentaje, dividiendo el número de ramas vivas, entre el total y multiplicados por 100.
Porcentaje de enraizamiento: se contabilizó brotes con presencia de raíces, con un tamaño mayor de 0,5 cm (Vásquez, et al., 2018). Luego estos fueron transformados a porcentaje dividiendo el número total de ramas enraizados sobre el total y multiplicado por 100.
Número de raíces: se contabilizaron las raíces, con tamaño mayor o igual a 0,5 cm (Vásquez et al., 2018).
Tamaño de raíces: las raíces fueron medidas con un vernier digital en mm, luego se transformó a cm, finalmente fueron promediados por repetición.
Análisis estadístico
Previo al análisis de varianza, las variables en porcentaje, sobrevivencia (Y) y enraizamiento (Y) se transformó con la función T= arcoseno (√ Y). Así mismo el número de raíces (Y) se transformó con la función logaritmo, [T = log10 (Y)], finalmente los valores promedios se retransformaron a las unidades originales, con la función [Y = 100 sen2 (T)], para variables en porcentaje y con la función Y [Y = 10T] para la variable número de raíces (Muñoz et al., 2009).
Se realizó el ANOVA con modelo para un factorial y comparación múltiple Tukey (α=0,05) para la sobrevivencia, así mimo para las variables porcentaje de enraizamiento, número y tamaño de raíces se realizó la prueba no paramétrica de Friedman y el Post-Hoc de Wilcoxon, para determinar la influencia de los sustratos y concentraciones de AIB. Para el procesamiento de datos se utilizó el software estadístico InfoStat versión 2019.
RESULTADOS Y DISCUSIÓN
Según el análisis de varianza para la sobrevivencia de ramas de C. officinalis evaluados a 60 días, se observó que existe diferencia significativa, entre los sustratos y concentraciones de AIB, actuando de forma individual e interaccionada (Tabla 2).
Tabla 2. - Análisis de varianza (P< 0,05) para la sobrevivencia de ramas juveniles
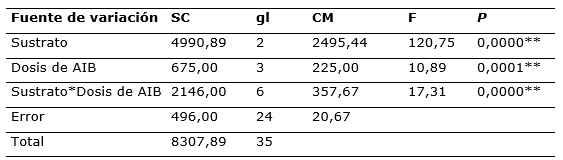
**=significación; SC: suma de cuadrados; gl: grados de libertad; CM: cuadrados medios; F: factor
Tabla 3. - Test de Tukey (α=0,05) para la sobrevivencia de estaquillas de quina, influenciados por tipo de sustratos y concentraciones de AIB
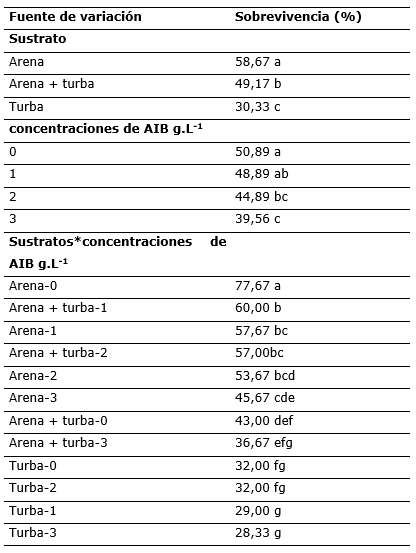
Se encontró que el sustrato arena fue superior respecto a los demás (Tabla 3), mostrando un porcentaje de brotes vivos de 58,67 %, el segundo sustrato fue la mezcla turba + arena con 49,17 %. Así mismo, se encontró que el sustrato turba presentó una alta mortalidad sobrepasando el 50 % de estaquillas tratadas. Es sabido que brotes tiernos y suculentos, en su mayoría mueren por pudriciones, básicamente influenciados por los sustratos, ya que algunos de ellos presentan características como baja porosidad, lo que generan sobresaturación de agua, por ende reduce la respiración de las mismas y crean ambientes favorables para la proliferación de algunos patógenos (Mesén, 1998), dicha afirmación refuerza lo encontrado respecto a la alta sobrevivencia de estaquillas en arena (alta porosidad) y baja sobrevivencia en turba (baja porosidad).
Se encontró que las estaquillas sobrevivieron mejor, cuando menor era la concentración de AIB, tal es así que las estacas sin auxinas sobrevivieron hasta un 50,89 %; concentraciones de 2 y 3 g.L-1 reportaron mayor porcentaje de mortalidad, probablemente por toxicidad (Inuma et al., 2018).
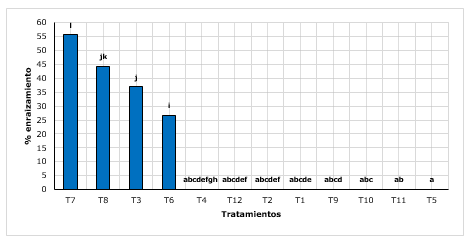
Figura 1.- Test Post-Hoc Wilcoxon para el porcentaje de enraizamiento según tratamientos
Medias con letra común no difieren significativamente
El tratamiento T7 (arena + turba con 2 g.L-1 de AIB), presentó un enraizado de 55,67 %, mostrando superioridad que el T8 (arena + turba con g.L-1 de AIB) con 44,33 %. Así mismo los demás tratamientos en su mayoría no emitieron raíces (Figura 1).
Villar et al., (2018), mencionan que la quina es una especie difícil de enraizar, debido al contenido de quinina, alcaloide que probablemente inhibe la formación de raíces. Por su parte, en otra investigación, Conde et al., (2017), contradice dicha afirmación, ya que encontraron resultados exitosos en el enraizamiento de quina mediante brotes juveniles aclimatados en vivero. Mencionan de hasta un 88,33 % a 96,67 % de enraizado, con y sin tratamientos auxínicos, por lo que exponen que no necesariamente dependen de los tipos de enraizadores, sino del manejo y mantenimiento que se les dé a los brotes durante el proceso en invernadero. Si bien es cierto los resultados reportados, se muestran superiores a lo encontrado en la presente investigación, sin embrago, dicha diferencia estaría afectado quizás por la procedencia del material vegetal, ya que se trabajaron con estaquillas colectados directamente de campo.
Para el enraizado de estaquillas, se encontró que el tratamiento con combinación arena y turba mostraron resultados superiores (55,67 %), respecto a los otros tratamientos. Así mismo, se observó en su mayoría que los tratamientos con contenidos de turba y concentraciones medias y bajas de AIB reportaron 0 % de enraizamiento. Hartmann y Kester (1987), mencionan que los sustratos presentan efectos significativos en el enraizado de plantas, variando estos según el material vegetal y la especie, resaltando además que el mejor sustrato es turba, y si se combina con arena en diferentes proporciones, ésta se repotencia su actividad.
La concentración 2 g.L-1 de AIB sobresalió en el enraizado (55,67 %), seguido por la concentración 3 g.L-1 (44,33 %); al respecto, (Hartmann y Kester, 1987; Vásquez, et al., 2018), mencionan que existe efectos positivos de las auxinas en el enraizamiento, ya que estimulan la división celular, aumenta el transporte de carbohidratos y otros cofactores foliares a los sitios de aplicación, así como a la estimulación en la síntesis de ADN en las células tratadas. Aunque, la sensibilidad de las células varía entre especies, dependiendo de un conjunto de factores intrínsecos (Norberto et al., 2001).
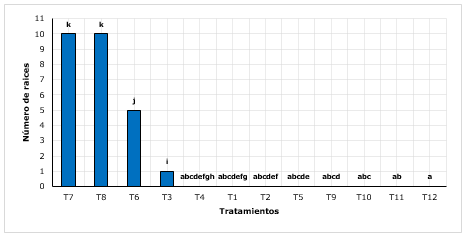
Figura 2. - Test Post-hoc Wilcoxon para el número de raíces según tratamientos.
Medias con
letra común no difieren significativamente
Para el número de raíces, se encontró que el tratamiento T7 (arena+ turba con 2 g.L-1 de AIB) y el T8 (arena + turba con 3 g.L-1 de AIB) obtuvieron el mayor número de raíces (10), superior a los demás tratamientos (Figura 2). Conde et al., (2017), menciona cuando se trabajan con brotes juveniles, incrementa la capacidad enraizativa, tal es así que, reportaron hasta 7 raíces, en promedio por brote. En otro estudio, Castañeda et al., (2019), encontraron un total de 4 raíces, siendo relativamente bajos comparado a lo encontrado, sin embargo, dichos resultados fueron encontrados en enraizamientos de quina mediante estacas lignificadas. Del mismo modo, reportaron que el sustrato sobresaliente en la formación de raíces, fue el sustrato (35 % hojarasca+35 % de franco arenoso+20 % tierra orgánica y 10 % arena).
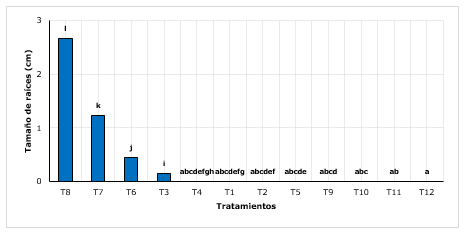
Figura 3. - Test Post-Hoc Wilcoxon para la longitud de raíces según tratamientos
Medias
con letra común no difieren significativamente
Respecto a la longitud de raíces, se encontró que el T8 (arena+ turba con 3 g.L-1 de AIB) lograron incrementar en promedio máximo a 2,66 cm, siendo superior al T7, T6 y demás tratamientos que en su mayoría no presentaron raíces (Figura 3). Es evidente que los sustratos influyen significativamente en el desarrollo radicular (Castañeda et al., 2019), raíces con tamaños de hasta 4 cm, influenciados por el sustrato (35 % hojarasca + 35 % de franco arenoso + 20 % tierra orgánica y 10 % arena).
Otro factor importante es el material vegetal que en función a su edad tienen capacidad de formar y desarrollar raíces, ya que el tejido juvenil responde mejor a los reguladores de crecimiento que el de células viejas y totalmente diferenciadas, probablemente porque las zonas del genoma que controlan la formación de órganos están menos reprimidas y pueden desbloquearse con los tratamientos con auxinas (Denaxa et al., 2012).
Por su parte, Conde et al., (2017) menciona que los mejores resultados de enraizamiento en quina, lo obtuvieron con brotes juveniles, los cuales generaban raíces con longitudes de 3,23 cm como promedio, siendo superior a lo encontrado en este estudio.
De esta forma, es posible además propagar árboles superiores de la especie asociados o no a un programa de mejoramiento arbóreo y facilitar los programas de rescate y conservación de especies (Figura 4).
 C
C
B Figura 4. A - Árbol plus de quina, en el bosque de neblina San Jerónimo-Perú; B- estaquilla con formación de callo a 15 días; C- estaquilla de quina enraizado a 60 días
La propagación vegetativa de quina se realizó a partir de ramas ortotrópicas juveniles en cámara de subirrigación, presentó alto porcentaje de sobrevivencia con el sustrato arena, no obstante, para el enraizamiento, número y longitud de raíces, el sustrato sobresaliente fue arena + turba, con concentraciones de 2 y 3 g.L-1 de AIB.
REFERENCIAS BIBLIOGRÁFICAS
ÁLVAREZ ALONSO, JOSÉ, 2013. El árbol de la calentura. Boletín Instituto Nacional de Salud, [en línea] vol. 19, pp. 214-215. Disponible en: https://repositorio.ins.gob.pe/handle/INS/296
BARRUTIA, R.R.R., BARRETO, I.B. y VELÁSQUEZ, T.D.M., 2020. Germinación de semillas de Cinchona officinalis L. en tres tipos de suelos de Cajamarca, Perú. Revista Cubana de Ciencias Forestales [en línea] vol. 8, no. 1, pp. 75-87. ISSN 2310-3469. Disponible en: http://cfores.upr.edu.cu/index.php/cfores/article/view/488/html
BUDDENHAGEN, C.E., RENTERIA, J.L., GARDENER, M., WILKINSON, S.R., SORIA, M., YÁNEZ, P., TYE, A. y VALLE, R., 2004. The Control of a Highly Invasive Tree Cinchona pubescens in Galapagos1. Weed Technology, [en línea] vol. 18, no. sp1, pp. 1194-1202. ISSN 0890-037X, 1550-2740. DOI 10.1614/0890-037X Disponible en: https://www.researchgate.net/publication/232663171_The_Control_of_a_Highly_Invasive_Tree_Cinchona_pubescens_in_Galapagos
CARAGUAY YAGUANA, K.A., ERAS GUAMAN, V.H., GONZÁLEZ ZARUMA, D., MORENO SERRANO, J., MINCHALA PATIÑO, J., YAGUANA ARÉVALO, M. y VALAREZO ORTEGA, C., 2016. Potencial reproductivo y análisis de calidad de semillas de Cinchona officinalis L., provenientes de relictos boscosos en la provincia de Loja-Ecuador. Revista Investigaciones Altoandinas, [en línea] vol. 18, no. 3, pp. 271-280. ISSN: 2306-8582. Disponible en: https://dialnet.unirioja.es/servlet /articulo?codigo=5645611
CASTAÑEDA, J.H.V., SABALETA, E.L., HERNÁNDEZ, M.K.Y.B., MEZA, S.N.V. y SÁNCHEZ, L.M.Q., 2019. Comparación de sustratos en la propagación sexual y asexual del árbol de la quina (Cinchona officinalis). Revista de Investigación en Agroproducción Sustentable, [en línea] vol. 2, no. 3, pp. 77-85. ISSN 2520-9760. DOI 10.25127/aps.20183.407. Disponible en: http://revistas.untrm.edu.pe/index.php/INDESDOS/article/view/407
CONDE MONTAÑO, M.E., MORENO SERRANO, J.A., ERAS GUAMÁN, V.H., MINCHALA PATIÑO, J., GONZÁLEZ ZARUMA, D., YAGUANA ARÉVALO, M. y VALAREZO ORTEGA, C., 2017. Multiplicación sexual y asexual de Cinchona officinalis L., con fines de conservación de la especie. Rev. Tzhoecoen [en línea], vol. 9, no. 1. ISSN 1997-3985. Disponible en: http://revistas.uss.edu.pe/index.php/tzh/article/view/463
DENAXA, N. K., S. N. VEMMOS, and P. A. ROUSSOS., 2012. The role of endogenous carbohydrates and seasonal variation in rooting ability of cuttings of an easy and a hard to root olive cultivars (Olea europaea L.). Sci. Hort. [en línea] Vol. 143, pp. 19-28. DOI: 10.1016/j.scienta.2012.05.026 Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0304423812002579
GÓMEZ SILVERA, A., BERAUN MACEDO, L.A., GÓMEZ RENGIFO, O.J. y LLATAS DUCEP, E., 2016. Procesos de regeneración natural de la quina o cascarilla (Cinchona spp.): en los bosques de neblina del distrito de Kañaris, región Lambayeque. Instituto Nacional de Innovación Agraria (INIA), [en línea] pp. 7. Disponible en: https://repositorio.inia.gob.pe/handle/inia/572
HARTMANN, H.T. y KESTER, D.E., 1987. Propagación de plantas: Principios y prácticas [en línea]. México: Continental. ISBN 978-968-26-0789-9. Disponible en: https://www.worldcat.org/title/propagacion-de-plantas-principios-y-practicas/oclc/503174286?referer=di&ht=edition
Conflicto de intereses:
Los autores declaran no tener conflictos de intereses.
Contribución de los autores:
Los autores han participado en la redacción del trabajo y análisis de los documentos.
![]()
Esta obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial
4.0 Internacional.
Copyright (c) 2020 Tito Sánchez
Santillán, Gelver Silva Valqui, Ariel Kedy Chichipe Puscan, Marcial Trigoso Pinedo, Leidy Gheraldinne Bobadilla
Rivera, Geidy Yecenia Jiménez
Yoplac