
Caracterización de la estructura del bosque de ciénaga, Unidad Zonal de Conservación “Cauto Sur”
Revista Cubana de Ciencias Forestales. 2017, 5(3):363-374
Caracterización de la estructura del bosque de ciénaga, Unidad Zonal de Conservación “Cauto Sur”
Characterization of the structure of the Swamp Forest Zonal Conservation Unit "Cauto Sur"
Karell Chala Arias1, José Luis Rodríguez Sosa2, Dayami Sánchez Pino3
1Máster en Ciencias Forestales. Facultad de Ciencias Agrícolas. Universidad de Granma. Cuba. Correo electrónico: kchala@udg.co.cu
2Doctor en Ciencias Forestales. Facultad de Ciencias Agrícolas. Departamento de Ingeniería Forestal. Universidad de Granma. Cuba. Correo electrónico: jrodriguezs@udg.co.cu
3Ingeniera Forestal. Empresa Agroforestal Granma. Cuba. Correo electrónico: dsanchezp@estudiantes.udg.co.cu
Recibido: 16 de octubre de 2017.
Aprobado: 22 de noviembre de 2017.
RESUMEN
El estudio se realizó en el bosque de ciénaga en la Unidad Zonal de Conservación “Cauto Sur”, refugio de fauna delta del Cauto, con el objetivo de caracterizar la flora vascular. Se realizó un muestreo aleatorio con 15 parcelas de 100 m², donde se registraron todos los individuos con más de 7 cm. de d1.30. El muestreo se validó con el método de la curva área-especie y distancia, además, fueron determinados los parámetros de la estructura horizontal: abundancia relativa, frecuencia relativa y dominancia relativa, también se estudiaron la estructura diamétrica y la estructura vertical. La diversidad del bosque de Ciénaga fue baja, representada por 27 familias, 40 géneros, 40 especies y 673 individuos; las familias más diversas fueron Leguminosae y Combretaceae. Según el origen fitogeográfico, el 61% de la flora fue de especies nativas; un 7% de especies endémicas y el 32% de especies exóticas. Se destaca la presencia de los taxones con categoría de amenaza Pictetia mucronata (Griseb). Beyra & Lavin, Catesbaea gamboana Urb y Thespesia cubensis (Britton y P. Wilson) J.B. Hutch. El estrato arbóreo dominante entre los 5 y 13 m. de altura estuvo representado por latizales, que denotaron el estado de regeneración en que se encuentra el bosque. Fueron Bucida subinermis Bissey Bursera simaruba (L.) Sarg, las especies mejor aclimatadas a las condiciones del sitio, propias del bosque de Ciénaga.
Palabras clave: Biodiversidad; Muestreo; Flora; Estructura; Amenazadas.
ABSTRACT
The study was carried out in the Swamp Forest in the Zonal Conservation Unit "Cauto Sur", refuge of delta of Cauto fauna, with the objective of characterizing the vascular flora. A random sampling was carried out with 15 plots of 100 m², where all individuals with more than 7 cm of d1.30 were recorded. Sampling was validated with the method of the area-species and distance curve, in addition the parameters of the horizontal structure were determined: relative abundance, relative frequency and relative dominance, the diametric structure and the vertical structure were also studied. The diversity of the swamp forest was low, represented by 27 families, 40 genera, 40 species and 673 individuals, the most diverse families were Leguminosae and Combretaceae. According to the phytogeographic origin, 61 % of the flora were native species, 7 % of endemic species and 32 % of exotic species. The presence of the threatened category taxa Pictetia mucronata (Griseb.) Beyra & Lavin, Catesbaea gamboana Urb and Thespesia cubensis (Britton & P. Wilson) J.B. Hutch. The dominant arboreal stratum between 5 and 13 m high, was represented by latizales, which denoted the state of regeneration in which the forest is located. They were Bucida subinermis Bisse and Bursera simaruba (L.) Sarg, the best acclimated species to the site conditions of the Swamp forest.
Key words: Biodiversity; Sampling; Flora; Structure; Threatened.
INTRODUCCIÓN
La diversidad ecológica o de ecosistemas concierne a la heterogeneidad de ecosistemas presentes en una región o zona dada y se entiende como el conjunto de individuos, poblaciones y especies que ocupan un área definida, incluidas todas sus interacciones con el medioambiente. Entre los componentes de la diversidad ecológica se hallan los biomas, los paisajes y los hábitats.
La riqueza de especies es la principal variable descriptiva de la biodiversidad, lo que le confiere una gran importancia en los estudios de la diversidad biológica. Jiménez y Hortal, [2003].
Como consecuencia del uso incontrolado de la vegetación y la consiguiente transformación del paisaje natural, actualmente, en el ámbito nacional e internacional, existen serios problemas derivados de la importante disminución de las masas vegetales naturales, lo que guarda relación con la extinción de especies, la erosión incontrolada, la desertificación, las inundaciones y el aumento de la contaminación. González, et al. [2016].
Los bosques siempreverdes de ciénaga son ecosistemas estratégicos para la humanidad, por ser corredores biológicos y de flujo genético que conectan pequeñas reservas. Son ecosistemas particulares de gran importancia para el trópico, pues albergan numerosa fauna silvestre y desempeñan funciones de sustento y recreación para la población, FAO [2002]; por ello, este trabajo parte del objetivo: caracterizar la flora vascular del bosque de ciénaga de la UZC “Cauto Sur”, refugio de fauna “Delta del Cauto”.
MATERIALES Y METODOS
Descripción del área de estudio
El refugio de fauna “Delta del Cauto” está ubicado en la porción suroriental del archipiélago cubano, al oeste del municipio río Cauto en la provincia de Granma. Limita al norte con el municipio Jobabo de la provincia Las Tunas; al sur, con el municipio Yara; al este, con la camaronera y al oeste, con el Golfo de Guacanayabo.
Se realizó un muestreo aleatorio donde se muestrearon 15 parcelas de 100 m² (10 m. x 10 m.) con un área total de 1 500 m2 (1,5 ha.); se registraron todos los individuos con más de 7 cm. de D (1.30); para el establecimiento se siguió la metodología planteada por Malleux [1982], citado por Ortiz y Carrera [2002] que certifican la idoneidad de la misma para bosques heterogéneos, al tener una mayor representatividad de las especies del bosque.
El muestreo se validó con el método de la curva área-especie y distancia Cantos [2013].
Estructura horizontal
Se determinaron los parámetros de la estructura horizontal a través del cálculo de: abundancia relativa, frecuencia relativa y dominancia relativa [Mostacedo y Fredericksen, 2000 y Moreno, 2001], así como el índice valor de importancia ecológica de las especies, IVIE [Boscopé y Jorgensen, 2005; Curtis y McIntosh, 1950; Keels, Gentry, y Spinzi, 1997 y Lamprecht, 1990]. Se determinó a través de la siguiente fórmula:
IVIE = AR+ DR + FR [1]
Además, se evaluó la estructura diamétrica del bosque a partir del procedimiento descrito en la metodología de Lema [1995], citada por Melo y Vargas [2003]. Las clases quedaron organizadas con intervalos de 6 cm., como sigue: clase I (5-11), II (11,1-17) III (17,1-23), IV (23,1-29), V (29,1-35), VI (35,1-41), VII (41,1-47).
Estructura vertical
Para la determinación de la estructura vertical, fue necesario utilizar la metodología propuesta por Cuevas, López y García [2002]. Las clases quedaron organizadas con intervalos de 2 m., como siguen: clase I (3-5), II (5.1-7), III (7.1-9), IV (9.1-11), V (11.1-13), VI (13.1-15), VII (15.1-17).
RESULTADOS Y DISCUSIÓN
Validación del muestreo
La curva área-especie (Fig. 1) indicó que el muestreo realizado fue suficiente para representar la composición florística del bosque. Con 14 parcelas, se alcanzó un 95 % del total de especies en el muestreo, pero el incremento en la intensidad de muestreo no provee un aumento significativo en la riqueza de especies, lo cual coincide con lo planteado por Canto [2013], al explicar que para cálculos de diversidad es conveniente utilizar curvas de área–especie.

Características florísticas del bosque de ciénaga
Considerando el hábito de crecimiento de las especies (Fig. 2), la masa forestal en estudio muestra un dosel abierto ya que los elementos florísticos, distintos de los árboles, representan el 57 % de la composición. La situación de las lianas, que en su mayoría son elementos florísticos de carácter heliófilo, al igual que las hierbas, permite inferir que la entrada de luz a los estratos bajos del bosque es considerable. Estructuras de esta tipología de bosque han sido referidas por Reyes [2012].
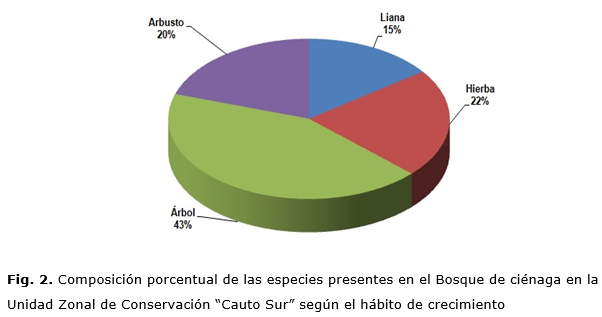
La flora registrada en el área de estudio incluyó 27 familias, 40 géneros, 40 especies y 673 individuos.

Las familias mejores representadas en cuanto a la riqueza de especies (Fig. 3) fueron Leguminosae con cuatro taxones, seguida de Combretaceae con tres y Cactaceae, Rutaceae, Bromeliaceae y Capparaceae representadas solo por dos especies, lo que denota una diversidad florística alta, al tener en cuenta el grado de deterioro manifestado por las evidencias de modificación de la vegetación originaria para estos tipos de bosques, como expresa Reyes [2012].
Teniendo en cuenta el origen fitogeográfico de las especies, es meritorio resaltar la presencia de un 7 % de especies endémicas, las cuales, exceptuando a Pictetia mucronata (Griseb.) Beyra & Lavin, son categorizadas como amenazadas. González, et al. [2016] Catesbaea gamboana Urb [Amenazada], Thespesia cubensis (Britton & P. Wilson) J.B. Hutch. [En Peligro]. Estas especies resaltan el valor ecológico de la vegetación en estudio y sugieren la focalización del trabajo de vigilancia de las mismas para su conservación, así como considerarlas objeto de conservación para la elaboración de estrategias de restauración del ecosistema.
También es necesario destacar que el 61 % de la flora se corresponde con especies nativas, indicando mayor correspondencia con la vegetación típica del bosque siempreverde de ciénaga, descrita por Capote y Berazaín [1984] y Reyes [2012].
Análisis de la estructura horizontal
Estructura diamétrica
La distribución diamétrica de la vegetación (Fig. 4) se asemejó a la forma típica de una J invertida, representativa de un bosque natural, quedando expresada en siete clases diamétricas. Este comportamiento es propio de los bosques irregulares con predominio de las clases inferiores [Higuchi, et al., 2008; Louman, Quiros y Nilsson, 2001; Pérez, et al., 2001 y Ruschel, et al., 2009]. De esta forma, la reserva de árboles pequeños de las primeras clases de diámetros es lo suficientemente abundante para asegurar el equilibrio del bosque [Higuchi, et al., 2008 y Ruschel, et al., 2009].
La estructura diamétrica se caracterizó porque el 53,1 % de los individuos (118), presentaron diámetros menores a los 11 cm. Como se aprecia, existe una reducida abundancia de árboles en las clases diamétricas superiores, a partir de 23,1 cm. a 47 cm. (Clases IV a la VII), lo que puede indicar que estas han sido las más aprovechadas y según Labrada [2017] estos recursos son utilizados en cierta medida por las comunidades asociadas al área, fundamentalmente para varas, horcones, largueros, tablas para construcciones de viviendas, cujes y postes para la construcción de cercas y, en mayor medida, el uso de leña para material combustible de uso doméstico, no obstante, la distribución indica un mayor agrupamiento de los individuos en las clases menores, disminuyendo la abundancia de los mismos hacia las clases de mayor diámetro, comportamiento típico de bosques naturales. Lamprecht [1990] y Malleux [1982], citado por Morales [2012].
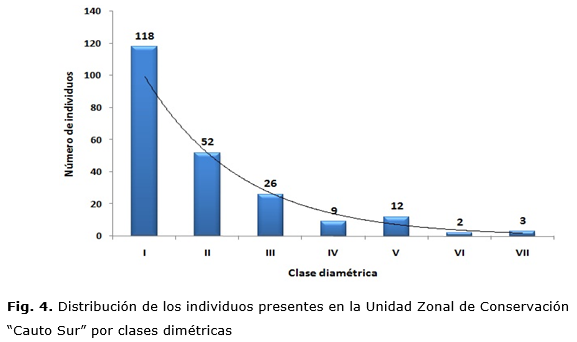
Las especies con mayor representación en la estructura diamétrica del bosque fueron Bucida subinermis y Bursera simaruba, las cuales son aparentemente tolerantes a desórdenes de origen antrópico o natural, por lo tanto, son ellas las mayores productoras de biomasa y las de mejores condiciones para soportar la propia dinámica del bosque.
Las de menor participación en las clases diamétricas fueron Conocarpus erectus L. var. Erectus, Zanthoxylum fagara (L.) Sarg y Acacia sp.
Clases de frecuencia
La distribución de las frecuencias en el histograma de presencia (Fig. 5) pone de manifiesto la heterogeneidad de la vegetación, revelado por la concentración de las especies en las clases I y II, que según Lamprecht [1990] y Melo y Vargas [2003] constituyen un indicador de heterogeneidad florística acentuada. Además, solo se encuentran tres especies con distribución horizontal continua, agrupadas en las clases IV y V, o sea, las especies se distribuyen irregularmente en la vegetación y el bosque está fisonómicamente identificado por tres especies: Bucida subinermis L., Bursera simaruba (L.) y Caesalpinia vesicaria L.
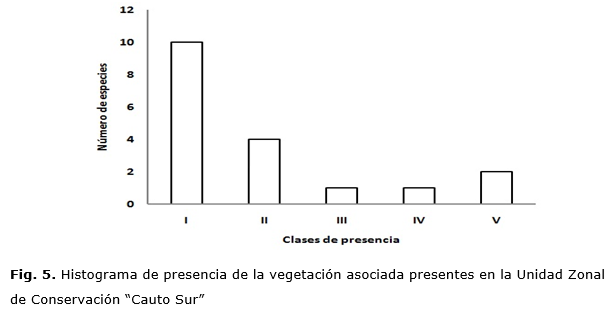
La presencia de Thespesia cubensis y Pictetia mucronata, entre las de menor frecuencia, es un dato importante a tener en cuenta, ya que son especies amenazadas [González, etal. 2016] y aumentan la importancia de la vegetación, por lo que debe prestársele especial atención y mayor cuidado en los planes de manejo para mejorar la estructura del bosque.
Importancia ecológica de las especies
El índice de valor de importancia permite comparar el peso ecológico de las especies dentro de la comunidad vegetal. Alvis [2009], citado por Cantos [2013]. Conforme al índice de valor de importancia ecológico calculado, la vegetación se caracterizó como heterogénea y rica en especies (Fig. 6), ya que según Melo y Vargas [2003] esto ocurre siempre que el mayor peso ecológico favorezca a las especies raras en su conjunto (40 especies).

Las especies de mayor peso ecológico en el bosque fueron Bucida subinermis y Bursera simaruba, lo cual responde a su abundancia y a la presencia de los mayores árboles de la masa; por otra parte, el resto de las especies ha respondido a su abundancia y distribución en el bosque. Esto demuestra la presencia de condiciones limitantes para el crecimiento y desarrollo de la flora en este tipo de bosque.
De igual forma, el valor de importancia ecológico de Quadrella cynophallophora y Guazuma ulmifolia Lam, respondió a su distribución (frecuencia relativa). Entre las especies de menor peso ecológico estuvieron Thounidium pulverulentum (Griseb.) Radlk, Cynophalla flexuosa (L.) LJ. Presl, Buchenavia tetraphylla (Aubl.) R.A. Howard y Thespesia cubensis (Britton & P. Wilson) J.B. Hutch., teniendo en cuenta que esta última ostenta la categoría En Peligro, debido a que su madera es muy utilizada para la construcción de muebles.
Estructura vertical de la vegetación
La estructura vertical de la vegetación (Fig. 7) es irregular y está representada por una gran cantidad de individuos en las clases que incluyen los árboles edificadores del dosel principal del bosque.
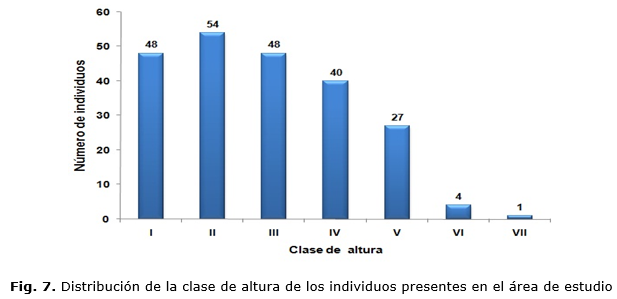
En la vegetación evaluada, los árboles con mayor tamaño se encontraban hasta los 15 m. de altura (árboles emergentes: Bucida subinermis, Bursera simaruba, estando el estrato arbóreo dominante entre los 5 m. y 13 m. de altura, encontrándose la mayoría de los árboles en el estado latizal, (latizal bajo y latizal alto). Las especies presentes en el estrato dominante son: Caesalpinia vesicaria, Bursera simaruba, Phyllostylon rhamnoides (J. Poiss.) Taub, Guazuma ulmifolia y Thespesia cubensis. Esta escasa definición de los estratos en el bosque sugiere que el mismo está en proceso de sucesión, al incorporarse especies de estratos inferiores a los superiores por la acción propia del hombre con la tala de algunos árboles o a la depauperación de la estructura vertical por la afectación de los bejucos.
Concluyendo se puede expresar que la diversidad del bosque de Ciénaga estuvo representada por 27 familias, 40 géneros y 40 especies, siendo las familias más diversas Leguminosae y Combretaceae, las que reportaron alto grado de naturalidad, un bajo endemismo y considerable estado de alteración florística.
El estrato arbóreo dominante estuvo representado por latizales, que denotaron el estado de regeneración en que se encuentra el bosque.
Bucida subinermis y Bursera simaruba determinan la fisionomía del bosque de ciénaga de la Unidad Zonal de Conservación Cauto Sur.
REFERENCIAS BIBLIOGRÁFICAS
BASCOPÉ, F Y JORGENSEN, P. Caracterización de un bosque montano húmedo: Yungas, La Paz. Ecología en Bolivia, 2005, 40(3), 365-379.
CANTOS, G. Caracterización estructural y propuesta de restauración del bosque nativo de la comuna el pital, zona de amortiguamiento del parque nacional Machalilla, Ecuador. [Tesis presentada en opción al grado científico de doctor en ciencias forestales]. Univ. De Pinar del Río, Cuba, 2013.
CAPOTE, P. Y BERAZAÍN, R. Clasificación de las formaciones vegetales de Cuba. Revista de Jardín Botánico Nacional, 1984, 5(2), 27–75.
CUEVAS, G.; LÓPEZ, M. Y.; y GARCÍA, M. Primer registro de Desmopsis trunciflora (Schlecht y Cham) G. E. Schatz (Annonaceae) para el occidente de México y análisis de su población en la Sierra de Manantlán, Jalisco. Acta Botánica Mexicana, 2002, (58), 7-18.
CURTIS, J Y MCINTOSH, R. The inter relation of certain analytic and syn-thetic phytosociological characters. Ecology, 1950, (31), 434-445.
FAO. [en línea]. 2002. [consultada el 2 de mayo del 2013]. Disponible en: www.fao.org/forestry/site/13087/es
GONZÁLEZ, T. et. al. Lista roja de la flora de Cuba. Bissea, 2016, 10(no. especial 1), 1-352.
HIGUCHI, P. et.al. Dinâmica da comunidade arbórea em um fragmento de floresta estacional semidecidual montana em Lavras, Minas Gerais, em diferentes classes de solos. Revista Árvore, 2008, 32(3), 417–426. [consultada el 2 de mayo del 2013]. Disponible en: http://web.catie.ac.cr/informacion/RFCA/rev34/pag66.pdf
JIMÉNEZ, V. y HORTAL, J. Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos, revista ibérica de aracnología, Departamento de Biodiversidad y Biología Evolutiva (Entomología). Madrid, España: Museo Nacional de Ciencias Naturales (C.S.I.C.), 2003.
KEELS, S., GENTRY, A., y SPINZI, L. Using vegetation analysis to facilitatethe selection of conservation sites in eastern Paraguay. Washington: SI/MAB: (Biodiversity measuring and monitoring certification training, volume 2), 1997.
LABRADA, P. Plan de manejo “Delta del Cauto”. 2017-2021. 2017.
LAMPRECHT, H. Silvicultura en los Trópicos. Los ecosistemas forestales en los bosques tropicales y sus especies arbóreas – posibilidades y métodos para un aprovechamiento sostenido. República Federal de Alemania: Ed: Cooperación Técnica, 1990.
LOUMAN, B.; QUIRÓS, D. Y NILSSON, M. Silvicultura de bosques latifoliados tropicales con énfasis en América Central. Turrialba: CR, CATIE, 2001.
MELO, O. Y VARGAS, R. Evaluación ecológica y silvicultural de ecosistemas boscosos. Crq, carder, corpocaldas, Cortolima: Universidad del Tolima, 2003. ISBN 956- 9243-03-07.
MORALES, S. Diversidad y estructura horizontalen los bosques tropicales del Corredor Biológico de Osa, Costa Rica. Revista Forestal Mesoamericana Kurú (Costa Rica), 2012, 9(23), 2215-2504.
MORENO, C. Métodos para medir la biodiversidad. Zaragosa, España: M & T-Manuales y Tesis SEA, 2001.
MOSTACEDO, B Y FREDERICKSEN, T. Manual de Métodos Básicos de Muestreo y Análisis en Ecología Vegetal. Santa Cruz de la Sierra. Bolivia: Proyecto de Manejo Forestal Sostenible (BOLFOR), 2000.
ORTIZ, E Y CARRERA, F.Estadística Básica para Inventarios Forestales. En: Orozco, L. y Brumer, C. Inventarios Forestales para Bosques Latifoliados en América Central, 2002, p.71 – 117.
PÉREZ, M. et.al. Composición y diversidad de los bosques de la Región Autónoma del Atlántico Norte de Nicaragua. Revista Forestal Centroamericana [en línea]. 2001, (34), 66–72. [Consultado 23 feb 2014]. Disponible en: http://web.catie.ac.cr/informacion/RFCA/rev34/pag66.pdf
REYES, O.Clasificación de la vegetación de la Región Oriental de Cuba. Revista del Jardín Botánico Nacional, 2012, 59(71), 32-33.
RUSCHEL, A. et.al. Caracterização e dinâmica de duas fases sucessionais em floresta secundária da Mata Atlântica. Revista Árvore, 2009, 33(1). 101–115.