
Efecto de reguladores de crecimiento tipo auxínico para la regeneración de tejido vegetal en Bursera graveolens
Revista Cubana de Ciencias Forestales. 2017, 5(3):259-269
Efecto de reguladores de crecimiento tipo auxínico para la regeneración de tejido vegetal en Bursera graveolens
Effect of growth regulators of auxinic kind for tissue vegetable regeneration in Bursera graveolens
Otto Francisco Mero Jalca1, Elias Cuásquer Fuel2, Lucy Maritza García Lucas3, Marcos Pedro Ramos Rodríguez4, Alfredo Jiménez González4
Carrera de Ingeniería Forestal, Coordinador de la Carrera. Universidad Estatal del Sur de Manabí. Ecuador. Correo electrónico: otto.mero@unesum.edu.ec
Carrera de Ingeniería Forestal, Docente. Universidad Técnica de Quevedo. Ecuador.
Especialista. Departamento de Relaciones Internacionales. Universidad Estatal del Sur de Manabí. Ecuador. Correo electrónico: negrito_alan@live.com
Carrera de Ingeniería Forestal, Docente. Universidad Estatal del Sur de Manabí. Ecuador. Correo electrónico: marcos.ramos@unesum.edu.ec ; alfredo.jimenez@unesum.edu.ec
Recibido: 30 de abril de 2017.
Aprobado: 5 de octubre de 2017.
RESUMEN
Bursera graveolens (palo santo) es una especie nativa muy utilizada por sus propiedades medicinales. Esta especie crece a orillas de quebradas y en montañas bajas y medias de hasta 1 300 m. snm en las costas de Ecuador y Perú. Esta investigación tuvo el objetivo de evaluar el efecto de reguladores de crecimiento tipo auxínico para la regeneración de tejido vegetal en B. graveolens. Las muestras de la especie se recolectaron en el bosque seco tropical ubicado en la comuna Quimis, Cantón Jipijapa, provincia de Manabí. Se emplearon cuatro concentraciones de auxina: ácido indolbutírico (AIB) (2 000, 4 000, 6 000, 8 000 ppm) para la regeneración de estaquillas de la especie objeto de estudio. Después de la siembra se registró a diferentes intervalos de tiempo la producción de brotes, callos y raíces, así como la mortalidad. Se utilizó un diseño completamente al azar con cuatro repeticiones. El procesamiento estadístico consistió en un análisis de varianza (ANOVA) y la prueba de Tukey para probar las diferencias entre las medias de los tratamientos. El sustrato utilizado fue tierra del bosque seco, tierra de guaba y arena de río, en una proporción de 4:2:1. Los mejores resultados de producción de brotes y callos, así como menor mortalidad, se alcanzaron con el tratamiento T4 (AIB en dosis de 8 000 ppm). En estos ensayos, no hubo formación de raíces en ninguno de los tratamientos, pero sí presencia de callos a los 60 días después de la siembra, obteniéndose medias por estaquillas entre 5,00 (tratamiento 3) y 11,25 (tratamiento 4).
Palabras clave: Ácido indolbutírico, biotecnología, brotes, callos, raíces, reproducción asexual.
ABSTRACT
Bursera graveolens (palosanto) is a native species widely used for its medicinal properties. This specie grows on the banks of canyon and in low and medium mountains up to 1,300 m above sea level on the coasts of Ecuador and Peru. This research aimed to evaluate the effect of auxin-type growth regulators for the regeneration of plant tissue in B. graveolens. Samples of the species were collected in the tropical dry forest located in Quimis, JipijapaTown, Manabí province. Four concentrations of auxin indole-butyric acid (IBA) (2,000; 4,000; 6,000; 8,000 ppm) were used for the regeneration of cuttings of the species under study. After sowing the production of shoots, calluses and roots was documented at different time intervals, as well as mortality. A completely randomized design with four replicates was used. Statistical processing consisted of an analysis of variance (ANOVA) and the Tukey test to check the differences between the means of the treatments. The substrate used was dry forest land, guava land and river sand, in a ratio of 4:2:1. The best results for shoot and callus production as well as lower mortality were achieved with the T4 treatment (AIB at 8,000 ppm dose). In this study there was no root formation in any of the treatments, but presence of callus at 60 days after sowingyielded averages between 5.00 (treatment 3) and 11.25 (treatment 4) per plant.
Key words: Indole-butyric acid; biotechnology; shoots; calluses; roots; asexual reproduction.
INTRODUCCIÓN
El aprovechamiento forestal tradicional, el cambio de uso de la tierra, los incendios forestales y el aumento de la población, entre otras causas, producen en Ecuador impactos tales como degradación de los bosques y pérdida de especies de valor comercial, causando afectaciones ambientales y a la diversidad biológica. En este contexto, se desarrolla la especie nativa Bursera graveolens (Kunth) Triana & Planch, la cual crece en bordes de quebradas o cañones cercanos al mar y en montañas bajas y medias de hasta 1 300 m. snm en las costas ecuatorianas y peruanas. Dicha especie ha sido utilizada como remedio para curar dolores estomacales, sudoríficos y como ungüento para reumatismo y también como sahumerio para espantar los mosquitos. Refiriéndose a esta especie, Manzano, et al. [2009], plantean que se debería impulsar proyectos para dar valor agregado a esta especie forestal del bosque seco, lo que mejoraría los ingresos económicos y la comunidad adquiriría mayor compromiso para protegerla.
B. graveolens pertenece a la familia Burseraceae y se aprovecha una vez que ha muerto naturalmente toda la planta o sus ramas, estado en el que es posible extraer los aceites esenciales e inciensos que son utilizados en aromaterapia. La madera muerta permite elaborar los productos que comercializa la firma Ecuadorians Hands y los pobladores locales. No obstante, es tal su aprovechamiento que la especie se encuentra en vía de extinción. En correspondencia con esto, debía protegerse el hábitat de la especie a través de medidas de conservación y desarrollar acciones para emprender programas de mejoramiento genético de la misma, siendo uno de los métodos la propagación, la utilización de reguladores de crecimiento tipo auxínico para la regeneración de tejido vegetal.
La principal ventaja, asociada a la utilización de la propagación vegetativa, se encuentra en el campo del mejoramiento genético, debido a que permite transferir aquellas características que, por su baja heredabilidad, no se traspasan eficientemente a la descendencia por vía sexual, mientras no se utilicen técnicas especiales como polinizaciones controladas o huertos biclonales. [Gutiérrez y Chung, 1994; citados por Carranza et al. 2012]. Además de la propagación, las técnicas de cultivo de tejidos in vitro también permiten seguir procedimientos modernos de conservación de germoplasma, gracias al mantenimiento prolongado de cultivos de crecimiento lento y la criopreservación de tejidos. [Vásquez et al. 2004; citados por Cuzco 2014]
La propagación vegetativa puede ser de interés para plantas que son difíciles de enraizar, además, puede mostrar incrementos sustanciales de los índices de multiplicación en periodos de tiempo relativamente cortos, demostrando tener gran importancia en la propagación asexual o vegetativa de plantas leñosas, sin embargo, según Carranza et al. [2012] hay que analizar las interacciones entre la morfología de las plantas y otros aspectos de la repoblación.
En 1935, el descubrimiento del efecto estimulante de las hormonas sobre el enraizamiento de estacas hizo posible la elaboración de nuevas técnicas de propagación. Se ha encontrado que algunas auxinas, como el ácido indol-butírico (AIB) y el ácido indol acético (AIA), estimulan la producción de raíces. [Kramm, 1987, Villegas, 1984, citados por Giraldo et al., 2009]
Las auxinas, según Ray [1977]; citado por Parrales [2015], entre ellas el ácido Indol Butírico (AIB), son enraizantes fitorreguladores naturales que sirven para la regeneración asexual de esquejes, estaquillas y plantones de especies frutales, forestales y ornamentales. Dicha auxina se mueve a través de los tejidos estrictamente en dirección basal, sin importar orientación, influencia externa de luz y gravedad. Por otra parte, es conocido que de acuerdo con las reservas alimenticias que tiene la raíz y la acumulación de AIB, se dispondrá en mayor o menor grado la brotación de raíces y el crecimiento de la planta y, por lo tanto, mejorará el desarrollo del sistema radicular.
La aplicación de reguladores de crecimiento, específicamente auxinas, se manifiesta en la velocidad y tasa de arraigamiento. [Santelices y Bobadilla, 1997; citados por Uribe et al., 2011]
En correspondencia con la problemática tratada anteriormente, esta investigación se desarrolló con el objetivo de evaluar el efecto de reguladores de crecimiento tipo auxínico para la regeneración de tejido vegetal en B. graveolens.
MATERIALES Y METODOS
Caracterización del área de estudio
El trabajo se desarrolló en el vivero forestal del laboratorio de Biotecnología de la Universidad Estatal del Sur de Manabí, ubicado en la coordenada 17M 0548191, UTM 9850653, Km 1,5 vía a Noboa. El clima es tropical seco y la altitud de 362 m. snm. El material vegetal de la especie objeto de estudio se recolectó en el bosque seco tropical, ubicado en la comuna Quimis, Cantón Jipijapa, región costera del Ecuador, sector sur de la provincia de Manabí, en las coordenadas 17M 0546383, UTM 9865460; 17M 0546387, UTM 9865459; 17M 0546375, UTM 9865453; 17M 0546368, UTM 9865482. La altitud era de 232 m. snm.
Diseño experimental
La investigación se basó en el método experimental. Se utilizó un diseño completamente al azar (DCA), formado por cinco tratamientos y cuatro repeticiones. Los tratamientos se definieron por las dosis de AIB utilizadas, siendo estos los siguientes: Tratamiento 1 (T1) AIB - 2 000 ppm; Tratamiento 2 (T2) AIB - 4 000 ppm; Tratamiento 3 (T3) AIB - 6 000 ppm; Tratamiento 4 (T4) AIB - 8 000 ppm y Tratamiento 5 (T5) el testigo. En cada una de las 20 parcelas experimentales se ubicaron 20 estacas, donde fueron evaluadas seis de ellas en cada caso, ubicadas las mismas en el centro de las parcelas para evitar el efecto de borde. Los parámetros considerados fueron: a) Número de brotes (evaluados a los 5 y 12 días después de realizada la siembra de las estaquillas); b) Longitud del brote mayor (se realizó a los 15 y 30 días después de la siembra; c) Presencia de callo y enraizamiento (se contabilizaron las plantas que tenían callo o raíz a los 30 y 60 días); d) Porcentaje de mortalidad (se contaron las estaquillas muertas a los 30 días y al final del ensayo).
Preparación de las concentraciones de auxina AIB
Los materiales utilizados en la elaboración y preparación del concentrado de auxina AIB fueron talco industrial, balanza de precisión, alcohol potable, matraces Erlenmeyer de 100 y 250 ml., estufa, espátula, agitador de cristal, colador y frascos de 100 ml. con tapa de rosca y la auxina en dosis de 2 000, 4 000, 6 000, 8 000 ppm, es decir, 20, 40, 60 y 80 mg.
Para preparar las distintas concentraciones en una balanza de precisión, se pesaron 10 g. de talco industrial, el cual fue tamizado, utilizando un colador pequeño para eliminar impurezas.
Las dosis de auxina AIB se diluyeron en 3 ml. de alcohol, utilizándose para esto un matraz Erlenmeyer de 100 ml. Esta dosis de auxina se adicionó al talco que estaba en el matraz de 250 ml., agregando 15 ml. de alcohol, dejándolo reposar por algunos minutos para luego moverlo continuamente hasta lograr una pasta homogénea. Las dosis de auxina se secaron en la estufa a 40 oC. por un tiempo de 6 horas. Finalmente se retiró la auxina de los matraces para ser cambiada a los frascos de vidrios de 100 ml. con tapa de rosca; se dejó reposar para luego ser utilizadas en las estaquillas de B. graveolens de acuerdo con cada uno de los tratamientos de la investigación.
Preparación del sustrato
El sustrato que se utilizó estuvo formado por cuatro porciones de tierra de campo del bosque seco de Quimis, dos porciones de tierra de guabo y una porción de arena de río; materiales que se mezclaron hasta obtener un sustrato homogéneo. Posteriormente se desinfectó el mismo con el insecticida Bala 55 (Clorpirito + Cipermetrina), efectivo por ingestión, contacto e inhalación y se utilizó una dosis de 60 cm3 en 20 l. de agua, dejando el material a utilizar saturado por el insecticida, por espacio de dos días; después fue depositado en las bandejas de plástico y quedó, de esa manera, listo para la siembra de las estaquillas de B. graveolens.
Obtención de las estaquillas
Las estaquillas se obtuvieron de cuatro árboles de B. graveolens cuyas edades oscilaban entre 6 y 10 años. Las ramas de estos árboles se colocaron en papel periódico humedecido para así evitar la deshidratación durante el traslado hasta el laboratorio. Se utilizó un calibrador para medir el diámetro de las ramas, el cual estuvo entre 6 y 8 mm. con longitudes de 10 a 12 cm. Las estaquillas fueron sumergidas en una solución de Vitavax (Carboxin+Captan) fungicida del grupo de las Oxatinas con efectos sistémicos y de contacto, a concentración de 1 gr.l-1 de agua por un tiempo de 10 minutos para su respectiva desinfección y quedar listas para la siembra.
Labores silviculturales durante el desarrollo del ensayo
Durante el desarrollo del ensayo se cumplieron las labores silviculturales siguientes:
Tratamiento estadístico
Para verificar el efecto de la auxina AIB (variable independiente) en la producción de brotes, callos y raíces (variable dependiente) en estaquillas de la especie forestal B. graveolens, se utilizó el análisis de varianza (ANOVA) y la prueba de Tukey para verificar las diferencias entre las medias de los tratamientos.
RESULTADOS Y DISCUSIÓN
Números de brotes por tratamiento
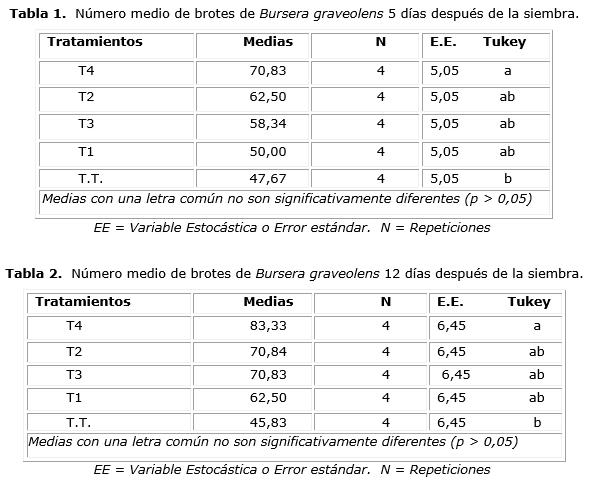
Los valores medios del número de brotes para cada uno de los tratamientos 5 y 12 días, después de la siembra, fueron similares (Tablas 1 y 2). El ANOVA realizado reveló la existencia de diferencia significativa en ambos casos, lo que mostró valores de significación de 0,0094 y 0,0128, respectivamente. Según la prueba de Tukey, el tratamiento T4 (AIB en dosis de 8 000 ppm) tuvo diferencias con el testigo en ambos casos.
En lo que se refiere a la incidencia de diferentes dosis de auxina AIB en la regeneración de estaquillas de la especie B. graveolens, no existen trabajos referentes a este tipo de ensayo, por lo tanto hay escasa información, sin embargo, existen estudios con otras especies del género Bursera [Bonfil-Sanders et al., 2007; Loeza et al, 2013 y Ríos et al., 2014]. El resultado obtenido en cuanto al número de brotes y enraizamiento después de la siembra no concuerda con los obtenidos por Ríos et al. [2014] en el trabajo realizado con Bursera glabrifolia (copal blanco) quienes aplicaron enraizador en la base y utilizaron sustrato mezcla 1:1 tierra de monte-perlita, lo que obtuvo que, trascurridos 60 días de la siembra, todas las estacas produjeron brotes y raíces.
La producción de brotes de B. graveolens en esta investigación alcanzó un 66,67 %, lo que concuerda con los resultados obtenidos por Ríos et al. [2014] en B. glabrifolia.
Longitud de los brotes
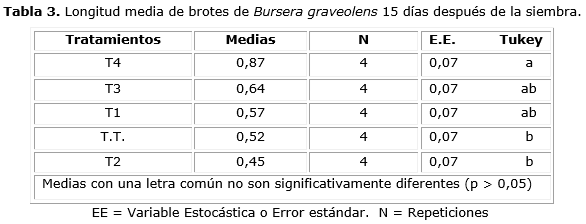
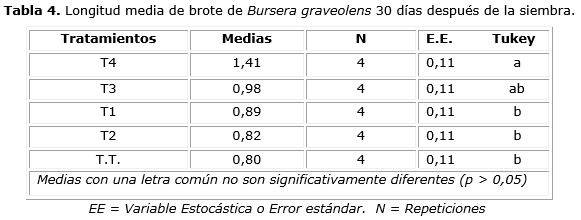
El ANOVA aplicado a los valores de longitud de los brotes de B. graveolens 15 y 30 días después de la siembra (Figura 1) reveló la existencia de diferencia significativa entre los tratamientos, con significación de 0,0094 y 0,0119, respectivamente. Según la prueba de Tukey entre el tratamiento T4 y el tratamiento T2 y con el testigo, existe diferencia (Tabla 3). Mientras que 30 días después de la siembra, el tratamiento T4 fue diferente al testigo y al resto de los tratamientos, excepto el tratamiento T3 (Tabla 4).

Presencia de callos y raíces 60 días después de la siembra
Los resultados relacionados con la presencia de callos 60 días después de la siembra se muestran en la Tabla 5. Se observa una diferencia significativa entre el valor medio del tratamiento T4 con el resto de los tratamientos y el testigo. El valor de significación obtenido al aplicar el ANOVA fue de 0,0002. Resulta interesante destacar que no hubo presencia de raíces en ninguno de los tratamientos, pero sí presencia de callos a los 60 días después de la siembra, lo que concuerda con los resultados obtenidos por Minchala-Patiño et al. [2013], quienes concluyeron que las concentraciones hormonales utilizadas de Roothoor y Hormonagro en las estacas de Tabebuia billbergii indujeron la formación de callos, lo que dificultó, de esta manera, la formación de raíces.
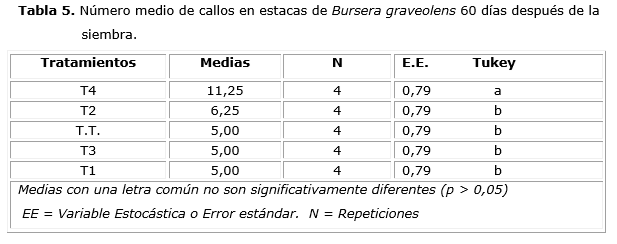
La formación de callos fue baja, incluso en el tratamiento T4, lo cual no concuerda con Bonfil-Sanders et al. [2007], quienes realizaron estudios preliminares con el fin de desarrollar métodos de propagación asexual de especies del género Bursera. Ellos utilizaron estacas de B. lancifolia, B. longipes, B. fagaroides, B. bicolor, B. glabrifolia, B. copallifera y B. bipinnataen, aplicando AIB en polvo (1 500 y 10 000 ppm). Las estacas se mantuvieron por cuatro meses en bolsas. El porcentaje de formación de callos fue alto (27-85%) en seis especies. No obstante, no hubo respuesta significativa en producción de raíces con la aplicación de AIB, registrando B. longipes y B. bicolor una baja producción de raíces (9 y 11%). En este sentido, Loeza-Corte et al. [2013], concluyeron que para inducir raíces adventicias en B. morelensis es necesario que las estacas a enraizar tengan bajo nivel de lignificación, mientras que recomiendan utilizar estacas con mayor grado de lignificación para propagar B. galeottiana.
Mortalidad de las estaquillas
El ANOVA aplicado a los valores obtenidos de mortalidad de las estaquillas mostró diferencias entre los tratamientos (significación de 0,0004) y fue menor la mortalidad en el tratamiento T4 30 días después de la siembra (Tabla 6). No obstante, 60 días después de la siembra la mortalidad de las estaquillas fue del 100% en todos los tratamientos y el testigo.
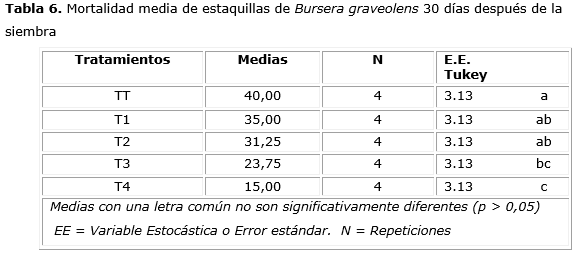
En relación con el número de brotes y su longitud después de la siembra de la especie objeto de estudio, se apreció un buen porcentaje en el tratamiento de AIB en dosis de 8 000 ppm, la mayor concentración; pero, al transcurrir las semanas, comenzaron a amarillarse y caerse los mismos. Esto pudo deberse a que las dosis de auxina de AIB aplicadas a las estaquillas no influyeron significativamente en la regeneración de tejidos de brotes, callos y raíces. Los brotes y callos formados en esta investigación se debieron al almacenamiento de sustancias nutritivas que contenían los brotes de meristemos apicales de las estacas de B. graveolens.
Trabajando con Eucryphia glutinosa, Latsague et al. [2009], encontraron que la aplicación de AIB en las distintas concentraciones ensayadas no influyó significativamente (P > 0,05) en el porcentaje de estacas con formación de callos en el número de raíces ni en la longitud de estas.
Según Uribe et al. [2012], el efecto positivo de concentraciones bajas de AIB ha sido reportado en la literatura por Santelices y Bobadilla, 1997, citados por Uribe et al., 2011 y Latsague et al. [2009], quienes al trabajar con estacas semileñosas de Nothofagus glauca y Eucryphia glutinosa, respectivamente, obtuvieron mejores resultados con menores concentraciones de AIB.
De acuerdo con los resultados obtenidos en esta investigación, no hubo presencia de raíz en ninguno de los tratamientos, pero sí presencia de callo en un menor porcentaje porque, tal vez, la mayoría de estaquillas generalmente no generaron células parenquimatosas o vacuolas, las cuales son las que generan brotes, raíces y hojas.
En un ensayo realizado por Eras, et al. [2016], probando las hormonas Hormonagro 1 y Enraizador HV, no lograron inducir el enraizamiento de estacas de B. graveolens a pesar de los cuidados proporcionados a las mismas. Ellos solo obtuvieron la formación de brotes falsos o pseudobrotes, los que se fueron marchitando y secando gradualmente.
En ensayos de enraizamiento y formación de callos en estacas de siete especies del género Bursera, Bonfil-Sanders et al. [2007], obtuvieron que las especies mostraron diferencias significativas en su capacidad de formar callos y raíces. En general, la formación de callos fue superior a la de raíces.
Trabajando con tres especies del género Bursera, Castellano - Castro y Bonfirl [2013], obtuvieron que el porcentaje de estacas con raíces y el número de raíces por estaca difirió significativamente entre especies y en respuesta a la concentración de AIB y la edad de las plantas de origen. El porcentaje de enraizamiento aumentó en todas las especies cuando se aplicó AIB, pero la sensibilidad al mismo varió con el tipo de estaca. Las que provinieron de plantas juveniles alcanzaron mayores porcentajes de enraizamiento y respondieron menos a la aplicación del AIB.
Para futuros experimentos pudiera considerarse, además, la época del año. Uribe et al. [2011], trabajando con la especie Berberidopsis corallina y utilizando también la auxina AIB, observaron una elevada tasa de supervivencia (mayor de 95 %) en los tratamientos aplicados a las estacas recolectadas en las épocas de otoño e invierno, a diferencia de lo encontrado en las estacas recolectadas en verano donde el porcentaje fue significativamente inferior (menor de 45 %). A pesar de que las concentraciones de AIB no afectaron significativamente la capacidad de enraizamiento de las estacas de B. corallina, la interacción entre la concentración de AIB y la época de cosecha sí mostraron un significativo (P < 0,05) para el número de raíces.
También pudiera repetirse el ensayo que utilizó otra auxina. No obstante, Uribe et al. [2012], al evaluar el efecto independiente de dos auxinas, ácido naftalenacético (ANA) y AIB en el enraizamiento in vitro de microtallos de N. glauca, obtuvieron que la aplicación de AIB influyó significativamente (p < 0,05) en el porcentaje de microtallos con mayor número promedio de raíces (5,1) y longitud de estas (12,7 mm.) mientras que la concentración de ANA no incidió significativamente en estas variables.
REFERENCIAS BIBLIOGRÁFICAS
BONFIL- SANDERS, C.; MENDOZA-HERNÁNDEZ, P. E.; y ULLOA-NIETO, J. A. Enraizamiento y formación de callos en estacas de siete especies del género Bursera. Revista Agrociencia, 2007, 41(1), 103-109. ISSN: 1405-3195.
CARRANZA, M. et al. Propagación de Tabebuia donnell-smithii Rose (Guayacán blanco) utilizando hormonas de enraizamiento. Ciencia y Tecnología, 2012, 5(2), 17-26. ISSN: 1390-4051
CASTELLANOS-CASTRO, C.; y BONFIL, C. Propagation of three Bursera species from cuttings. Botanical Sciences, 2013, 91(2), 217-224. ISSN: 2007-4298.
CUZCO CUZCO, R. A. Propagación vegetativa de Aliso (Alnus acumin ata H.B.K) y Porotón (Erythrina edulis Triana ex Micheli), utilizando tres tipos de enraizadores. Tesis de fin de estudios inédita, Universidad Técnica del Norte, Ecuador, 2014.
ERAS, V. H. et al. Estudio fenológico y propagación de Bursera graveolens (Kunth) Triana & Planch, en la comunidad de Malvas, cantón Zapotillo, provincia de Loja. Bosques Latitud Cero, 2016, 6(2), 1-15. ISSN: 1390-3683
GIRALDO, L. A.; FABIO, H. y POLANCO, M. F. Efecto de dos enraizadores en tres especies forestales promisorias para la recuperación de suelos. Revista de Investigación Agraria y Ambiental, 2009, 10(1), 41-47. ISSN: 2145-6097
LATSAGUE, M.; SÁEZ, P.; y YÁÑEZ, J. Efecto del ácido indolbutírico en la capacidad rizogénica de estacas de Eucryphia glutinosa. Bosque (Valdivia), 2009, 30(2), 102-105. ISSN: 0304-8799
LOEZA-CORTE, J. M. et al. Efecto de lignificación de estacas sobre enraizamiento de Bursera morelensis Ram. y Bursera galeottiana Engl. en la Universidad de la Cañada en Teotitlán de Flores Magón, Oaxaca, México. Ciencia Ergo Sum, 2013, 20(3), 222-226. ISSN: 1405-0269.
MANZANO, P. et al. Efecto antiinflamatorio y composición química del aceite de ramas de Bursera graveolens Triana & Planch (palo santo) de Ecuador. Revista Cubana de Plantas Medicinales, 2009, 14(3), 45-53. ISSN 1028-4796
MINCHALA-PATIÑO, J. et al. Propagación sexual y asexual de cuatro especies forestales nativas y promisorias de la Región Sur del Ecuador. Revista CEDAMAZ, 2013, 3(1), 5-17. ISSN: 1390-5880
PARRALES VILLACRESES, J. C. Influencia de niveles de concentración de hormona AIB, en la inducción de brotes y raíces en estaquillas de Myroxylon balsamum (bálsamo). Tesis de fin de estudios inédita, Universidad Estatal del Sur de Manabí, Ecuador, 2015.
RÍOS, B. J.; ENRÍQUEZ DEL VALLE, J. R.; y RODRÍGUEZ-ORTIZ, G. Enraizado de estacas de Bursera grabrifolia, en vivero. Revista Mexicana de Agroecosistemas, 2014, 1(suplemento), 59. ISSN: 2007-9559.
URIBE, M. E. et al. Influencia de las auxinas sobre el enraizamiento in vitro de microtallos de Nothofagus glauca (Phil.) Krasser. Gayana Botánica, 2012, 69(1), 105-112. ISSN: 0016-5301
URIBE, M. E. et al. Propagación vegetativa de Berberidopsis corallina Hook. f., una especie en peligro de extinción, endémica de Chile. Gayana Botánica, 2011, 68(2), 135-140..