
Los ecosistemas costeros del suroriente de Cuba y su capacidad de recuperación tras un incendio
Revista Cubana de Ciencias Forestales. 2017, 5(2):194-206
Los ecosistemas costeros del suroriente de Cuba y su capacidad de recuperación tras un incendio
The coastal ecosystems of the south-east of Cuba and their resilience after a fire
Yenisey Revilla Góngora1, Abel Almarales Castro2, Miguel Ángel Castell Puchades2, Rosa María Brooks Laverdeza1, Jainer Costa Acosta2, Luz Margarita Figueredo Cardona3, Josefina Blanco Ojeda1
1Licenciado en Biología. Departamento de Botánica. Centro Oriental de Ecosistemas y Biodiversidad. Cuba.
Correo electrónico: yenisey@bioeco.cu ; rosamaria@bioeco.cu ; jblanco@bioeco.cu
2Investigador Agregado.
Centro Oriental de Ecosistemas y Biodiversidad. Cuba. Correo electrónico: aac@bioeco.cu ; miguel@bioeco.cu
3Jefa Dpto Botánica.
Centro Oriental de Ecosistemas y Biodiversidad. Cuba. Correo
electrónico: luz@bioeco.cu
Recibido: 21 de marzo de 2017.
Aprobado: 21 de julio de 2017.
RESUMEN
El fuego constituye uno de los agentes de perturbación más severos que pueden alterar las características de las comunidades. El objetivo de esta investigación consistió en determinar la magnitud del cambio de la diversidad florística, ocasionado por un incendio en un área de bosque semideciduo micrófilo de la reserva natural “El Retiro”, comprobando así su capacidad de recuperación en el tiempo. Para ello, se establecieron dos parcelas de 20 x 20 m., en un área conservada y un área quemada, las cuales se distanciaron 20 m. Estas parcelas se monitorearon tres veces durante el año 2013 y 2014; los resultados se presentan en cuatro etapas de muestreo. Se consideraron las variables de riqueza, recambio y abundancia relativa de las especies, las cuales se analizaron mediante curvas de rango-abundancia, índices de similitud y análisis multivariados. Fueron determinadas 72 especies, de las cuales 17 son endémicas y 16 son nuevos reportes para el área de estudio. El área quemada registró mayor riqueza específica que el área conservada, donde se destacó por su dominancia, en los inicios de la recuperación, las herbáceas Bothriochloa pertusa, Cynodon dactylon y Waltheria indica y la suculenta Agave underwoodii, con alto potencial de rebrote vegetativo. El número y la composición de especies, así como la similitud biológica entre el área quemada y la conservada, se incrementaron notablemente a partir de los 12 meses del monitoreo, lo cual indica un rápido proceso de recuperación del bosque afectado, caracterizado principalmente por la dominancia de arbustos y epífitas.
Palabras clave: bosque semideciduo; incendio; recuperación ecológica; plantas; Cuba.
ABSTRACT
The fire represents one of the most severe disturbance agents altering the communities’ characteristics. The objectives of the research are to determine the magnitude of the change of plants species diversity generated by a fire at the microphyll semideciduos forest of the natural reserve El Retiro, as well as their recovery capacity through the time. Forthat, two 20 x 20 m plots were established at the conserved and burned area, spaced at a distance of 20 m each other. The plots of the burned area were examined three times at the 2013 and 2014, and the results were presented in four sample stage. The variables were the richness, recruitment and relative abundance of the species, which wereanalyzed by means of abundance-range curves, similarity index and multivariate analysis. 72 species were determined, of which 17 are endemics and 16 are new record forthearea. The burned area contain the biggest species richness, emphasized for its dominance at the beginning of the recovery, the herbs Bothriochloa pertusa, Cynodondactylon and Waltheria indica,and the succulent Agave underwoodii, with a highpotential of vegetative resproute. The number and the species composition, and so the biological similarity between the burned and conserved area, were increasing considerably beginning from 12 months of monitoring, which indicate a rapid process of recovery of the burned forest, characterized mainly by the mshrubs and epiphytes dominance.
Key words: semideciduos forest; fire; ecological recovery; plants; Cuba.
INTRODUCCIÓN
Las perturbaciones constituyen eventos irregulares que causan cambios estructurales abruptos en las comunidades naturales, llegando a afectar la composición, distribución y abundancia de las especies, así como procesos ecológicos, tanto a nivel poblacional como de la comunidad (Sousa, 1984). A su vez, estos cambios originan nuevas oportunidades para el establecimiento de otras especies, principalmente las exóticas invasoras Harrison y Bruna, 1999]. Según Dayton (1971), los agentes de perturbación pueden ser de naturaleza física o biológica. Entre los primeros, se relacionan el fuego, las sequías, los huracanes, las inundaciones y los deslizamientos de tierra. Mientras, entre los agentes de naturaleza biológica se reconocen procesos como la depredación, la herbivoría o el parasitismo.
La influencia de la intensidad de la perturbación sobre la colonización de las especies ha sido mayormente estudiada en comunidades expuestas al fuego (Gill, 1981; Abrahamson, 1984; Fernández et al., 2010). En este sentido, se plantea que los árboles y arbustos, cuyas yemas sobre la superficie del suelo estén cubiertas por una gruesa capa de corteza resistente al calor, tienen mayor probabilidad de sobrevivir a un fuego de intensidad moderada. Por otro lado, los fuegos más intensos pueden llegar a destruir todos los tejidos vegetales expuestos. En estos casos, solamente aquellas especies que sean capaces de regenerar a partir de yemas subterráneas asociadas a rizomas, raíces o tubérculos, sobrevivirán y crecerán vegetativamente, Sousa, (1984), además de las especies cuya respuesta radica en la germinación a partir de semillas persistentes (Keeley, 1981; Szejner et al., 2011).
Los patrones de regeneración natural que se desarrollan en un hábitat afectado dependen de varios factores como: la intensidad y severidad de la perturbación creada, el tamaño y la forma, localización y grado de aislamiento, la heterogeneidad de su ambiente interno y el momento en que fue producido (Sousa, 1984).
En el bosque semideciduo micrófilo de la reserva natural “El Retiro”, se producen fuegos ocasionales que alteran las condiciones ecológicas de este ecosistema, así como las características poblacionales de las especies vegetales que allí coexisten, tales como: la riqueza, la composición y la abundancia de los individuos; por lo cual en este estudio se plantean las siguientes preguntas: a) ¿Cómo varían los diferentes atributos de la diversidad de especies de plantas en un área natural del bosque semideciduo micrófilo de la reserva natural “El Retiro”, afectada por el fuego, en comparación con la diversidad de especies presentes en una matriz de bosque natural conservado?, b) ¿En qué magnitud ocurre el recambio espacio-temporal de la composición de especies en un periodo de dos años? y c) ¿En qué medida el bosque afectado recupera las características distintivas de la flora típica presente en esta formación vegetal? El objetivo de esta investigación consistió en determinar la magnitud del cambio de la diversidad florística, ocasionado por un incendio en un área de bosque semideciduo micrófilo de la reserva natural “El Retiro”.
MATERIALES Y METODOS
Caracterización físico-geográfica de la reserva natural “El Retiro”
La reserva natural “El Retiro” pertenece al distrito fitogeográfico Media Luna- Cabo Cruz- Baconao [Samek, 1973], el cual se caracteriza por su alto número de especies y de endémicos distritales y orientales, así como por la fragilidad ecológica de sus ecosistemas.
De acuerdo con [Núñez et al., 1989], esta reserva se encuentra en la Región Oriental, Subregión Sierra Maestra, en el Área Terrazas Costeras del Sur de la Sierra Maestra y en la Subárea Terrazas Costeras de Mar Verde Baconao.
Los suelos son pardos y rendzinas rojas. Los primeros se presentan en las colinas, son ricos en carbonatos y muy poco profundos. Los del segundo tipo se presentan en las áreas más cercanas al mar, en las oquedades del diente de perro y en las diaclasas; son también ricos en calcio y muy poco profundos. La temperatura media anual oscila entre los 24 y 26°C (Montenegro, 1991), las lluvias varían entre los 200 y 800 mm., en el periodo poco lluvioso y lluvioso, respectivamente (Bermúdez y Durán, 1991).
Vegetación y Flora
En la reserva, se desarrollan varios tipos de vegetación como el bosque semideciduo micrófilo, el Matorral xeromorfo costero y subcostero, el Complejo de vegetación de costa rocosa y de costa arenosa, el Uveral y el Manglar. Para el área, se registran 252 especies de plantas fanerógamas, de las cuales 52 son endémicas, para un 20,6 % (Sánchez et al., 2007). Varias especies presentan distintos grados de amenaza, entre las cuales se pueden citar: Pictetia mucronata (Griseb.) Beyra & Lavin, Preocupación Menor; Terminalia eriostachya A. Rich., Vulnerable; Coccothrinax fagildei Borhidi & O. MuñizEn Peligro; Consolea macracantha (Griseb.) A. Berger, Dendrocereus nudiflorus (Engelm. ex Sauvalle) (Britton & Rose)y Ziziphus havanensis Kunth, en Peligro crítico (González et al., 2016).
Métodos
Se estudió un área totalmente quemada con una superficie de 3 600 m2, correspondiente al bosque semideciduo micrófilo de la reserva natural “El Retiro”. Para evaluar la dinámica de recuperación del área afectada, se seleccionó como unidad de comparación un área de superficie similar aledaña a la zona afectada, de la misma formación vegetal y en buen estado de conservación.
En el área conservada, se utilizó una curva de acumulación de especies para determinar el área mínima de la unidad de muestreo, estableciéndose dos parcelas de 20 x 20 m. (400 m2), tanto en el área natural sin perturbación, como en la zona afectada por el fuego. Estas parcelas fueron dispuestas de modo diagonal a lo largo de cada área, distanciadas aproximadamente a 20 metros y distribuidas de manera que evitasen el efecto del borde.
En el fragmento quemado, dichas parcelas fueron monitoreadas tres veces durante el año 2013 e igual cantidad en el 2014, cuyos resultados fueron resumidos y analizados en cuatro etapas de muestreo: 1ra etapa, enero-junio (2013); 2da etapa, julio-diciembre (2013); 3ra etapa, enero-junio (2014) y 4ta etapa, julio-diciembre (2014). En el caso del área conservada, solamente se hizo un muestreo en el mes de junio de 2013, debido a la estabilidad ambiental y grado de madurez que presenta este tipo de bosque. En cada parcela, se marcaron y contaron todos los individuos de las especies para el cálculo de la abundancia relativa y para determinar los valores del recambio en la composición de especies.
En cada prospección florística, se identificaron las especies en su medio y las de dudosa determinación fueron colectadas para su identificación en el Herbario BSC “Dr. Jorge Sierra Calzado” del Centro Oriental de Ecosistemas y Biodiversidad.
Como diversidad, se consideran la riqueza, la composición y la abundancia de las especies detectadas, teniendo en cuenta dos expresiones: la diversidad alfa puntual, como el número de especies de plantas fanerógamas encontradas en cada zona de estudio [Halffter y Moreno, 2005] y la diversidad beta temporal, como el recambio en la composición de especies en el área quemada entre las etapas de muestreo.
(Whittaker, 1972) sugiere que la diversidad beta puede cuantificarse como una medida de disimilitud, a partir del cálculo de un índice de similitud biológica, quedando como:
β = 100 – IS.
Donde IS representa el valor correspondiente del índice de similitud de [Sørensen, 1948] entre las etapas de estudio, cuya expresión matemática es:
IS = (2c / A + B) x 100.
Donde c es el número de especies comunes entre las etapas de muestreo, mientras A y B, representan el número total de especies presentes en cada etapa de muestreo del área afectada.
Para conocer el grado de recuperación de la flora en el área quemada en relación con el área conservada, se consideró el índice de similitud proporcional Magurran (1988) en cada etapa de muestreo. Este índice es adecuado cuando se combinan datos cualitativos de presencia-ausencia y datos cuantitativos como la abundancia de los individuos, expresándose como:
I Scuant = 2pN / (aN + bN).
Donde aN= número total de individuos en el sitio A (área conservada); bN= número total de individuos en el sitio B (fragmento quemado en cada etapa de muestreo); pN= sumatoria de la abundancia más baja de cada una de las especies compartidas entre ambos sitios.
La variación espacio-temporal de la riqueza, composición y abundancia de especies, se representa mediante Curvas de Rango-Abundancia (Feinsinger, 2003). Para conocer la ordenación espacial de las distintas etapas de muestreo del área quemada y el área conservada, se realizó un Análisis de Componentes Principales (PCA, Principal components analysis), utilizando matrices de correlación entre las variables de respuesta, las cuales se corresponden con los tipos biológicos registrados: herbácea, liana, arbusto, epífita, parásita y arbóreo. Se utilizó un análisis de correlación de Spearman para examinar la asociación de estas variables de respuesta con los componentes principales 1 y 2.
También se realizó un análisis de agrupamiento según el algoritmo de encadenamiento promedio o UPGMA (Unweighted pair-group average), considerando medidas de distancia basadas en el índice de similitud de Bray-Curtis entre las etapas de muestreo del área quemada y el área conservada. Todos los análisis estadísticos se realizaron utilizando el paquete estadístico PAST v.3.1.
Aún cuando las especies Bothriochloa pertusa (L.) A. Camus y Cynodon dactylon (L.) Pers., ambas de la familia Poaceae, aparecen de manera abundante en las dos áreas de estudio durante todas las etapas de muestreo, las mismas se descartan de este tipo de análisis debido a la imposibilidad de contar los individuos como elementos independientes. La bibliografía empleada para delimitar las especies fueron: León, 1946; León y Alaín 1951, 1953, 1957; y Bisse, 1988] y en la actualización de los taxones se siguió el criterio de García, 2010; y Acevedo y Strong, 2012.
RESULTADOS Y DISCUSIÓN
Se detectaron 72 especies de plantas fanerógamas, distribuidas en 60 géneros y 32 familias botánicas. Los géneros mejor representados de acuerdo con el número de especies son Tillandsia (Bromelliaceae)y Passiflora (Passifloraceae), con tres en cada caso. En cuanto a las familias más destacadas, según la riqueza específica, sobresalen Rubiaceae (siete), Fabaceae (seis) y Apocynaceae (cinco).
El número total de especies registradas en este estudio, representa el 28,7 % de la flora presente en la reserva natural “El Retiro”, Sánchez et al., 2007. Esta cifra se considera representativa si se tienen en cuenta la superficie de muestreo utilizada, el tiempo de estudio y la severa afectación producida por el fuego en dicha área. De hecho, las primeras observaciones, luego del fuego ocurrido a mediados de 2011, evidenciaron una pérdida considerable de las especies típicas de este ecosistema.
Resalta la existencia de 16 nuevos registros de especies para la reserva natural, así como la presencia de 17 especies de plantas endémicas, las cuales aparecen en ambas áreas estudiadas. De las especies endémicas, cinco son pancubanas, dos presentan categoría de multisectorial centro-oriental, seis son multidistritales en Oriente y cuatro son distritales.
Entre las áreas de estudio, el mayor número de especies se obtuvo en el fragmento quemado, registrándose 50 especies (69,4 % del total) en la última etapa de muestreo de 2014, pertenecientes a 47 géneros y 25 familias (Figura 1).

Se registra una mayor riqueza de especies y géneros en el fragmento quemado en la última etapa de muestreo en relación con el área conservada del bosque semideciduo micrófilo. La primera y segunda etapas de muestreo corresponden al año 2013; la tercera y cuarta etapa, al año 2014.
En el área conservada de las especies dominantes, sobresalieron por el número de individuos Agave underwoodii Trel., Croton mircifolius Griseb. En esta zona, ocho especies se consideran raras al estar representadas por un solo individuo, entre las cuales se pueden mencionar: Plumeria filifolia Griseb., P. obtusa L.y Pilosocereus polygonus (Lam.) Byles & Rowles (Fig. 2). También se destaca la presencia de 11 especies de plantas registradas solamente en esta área de bosque, las cuales son típicas de este tipo de ecosistema y evidencian la estabilidad ambiental del área conservada: Quadrella cynophallophora (L.) Hutch., Croton myricifolius Griseb., Erytroxylum rotundifolium Lunan, Hennonia myrtifolia Griseb., Lippia alba (Mill.) N.E. Br. ex Britton & P. Wilson, Passiflora penduliflora Bertero ex DC., Passiflora suberosa L., Pseudocarpidium aviccenioides (A. Rich.) Millsp., Stenocereus fimbriatus (Lam.) Lourteig, Tillandsia fasciculata Sw. var. fasciculata y Tohuinia trifoliata Poit..
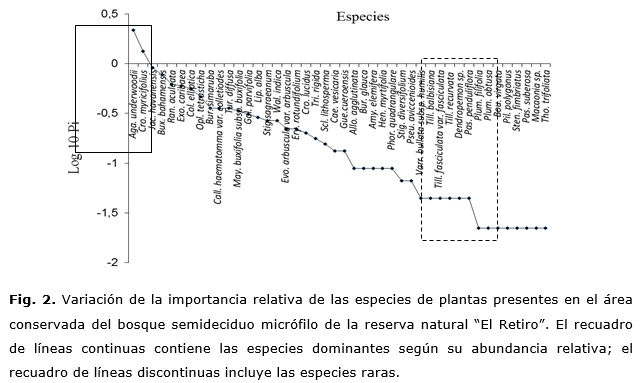
De las especies presentes en el fragmento quemado, el menor registro correspondió a la primera etapa de muestreo con solo 22 especies (30,5 % del total) incluidas en 21 géneros (Figura 1), donde se destacan por su dominancia las herbáceas Bothriochloa pertusa y Cynodon dactylon, las cuales ocupan el 75 % del área afectada. También son abundantes la especie suculenta Agave underwoodii y la herbácea leñosa Waltheria indica L. (Figura 3), cuyas respuestas a la perturbación provocada por el fuego se evidencian tras un rápido desarrollo de las estructuras quemadas mediante el rebrote vegetativo de las plantas. Constituyen por tanto, las primeras especies en establecerse en el hábitat con un elevado nivel de supervivencia.
En cambio, la escasa representatividad de especies en el primer periodo de estudio puede estar relacionada con el efecto combinado que ejercen varios factores. Entre estos, adquieren mayor importancia las escasas precipitaciones que se producen en este territorio; la intensa radiación solar que se proyecta sobre la superficie del fragmento quemado; la modificación de las características del hábitat, fundamentalmente del suelo, luego de producirse el incendio.
Lo anteriormente planteado coincide con los criterios de Trabaud, 1998; Ferrand y Vallejo, 1998]. Estos autores consideran que el ritmo de crecimiento de las especies en los estadios iniciales, luego de un incendio, están determinados por las características del fuego, el nivel de destrucción de tejidos y órganos de las plantas, incluyendo la biomasa subterránea y el banco de semillas, así como la influencia de las variables ambientales.
En la segunda etapa de muestreo, se registraron 39 especies, lo cual representa un incremento significativo del número de especies en relación con el primer periodo de estudio. Este incremento está determinado por la presencia de especies arbustivas, herbáceas y lianas como: Bourreria virgata (Sw.) G. Don, Varronia bullata L. subsp. humilis (Jacq.), Jacquemontia havanensis (Jacq.) Urb., Turnera diffusa Willd., Drypetes mucronata C. Wright ex Griseb., Lantana involucrata L.y L. camara L.var. camara. Estas son especies heliófilas de rápido crecimiento; por tanto, tienden a modificar la composición específica de las comunidades (Figura 3).
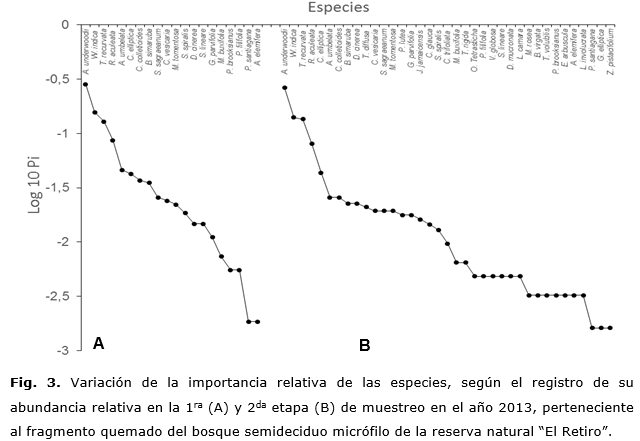
En ambos casos, las especies dominantes son Agave underwoodii y Waltheria indica.
Entre la tercera y cuarta etapa de muestreo, existe una tendencia menos variable en cuanto a la riqueza, el recambio en la composición y la abundancia relativa de las especies que coexisten en la comunidad (Figura 4). Esto sugiere la existencia de una mayor estabilidad temporal de la composición de especies hacia las últimas etapas de muestreo (diversidad beta=15,8 %), en relación con las dos primeras etapas, donde el recambio en la composición de especies es superior (diversidad beta=32,8 %). En las últimas etapas de muestreo, dominaron las especies de hábito epífito, arbustivo, herbáceas y lianas leñosas, como Tillandsia recurvata (L.) L., Agave underwoodii, Waltheria indica, Colubrina elliptica (Sw.) Brizicki & Stern. y Randia aculeata L., lo cual coincide con lo reportado por (Figueredo, 2015) para áreas similares de la reserva de biosfera Baconao.
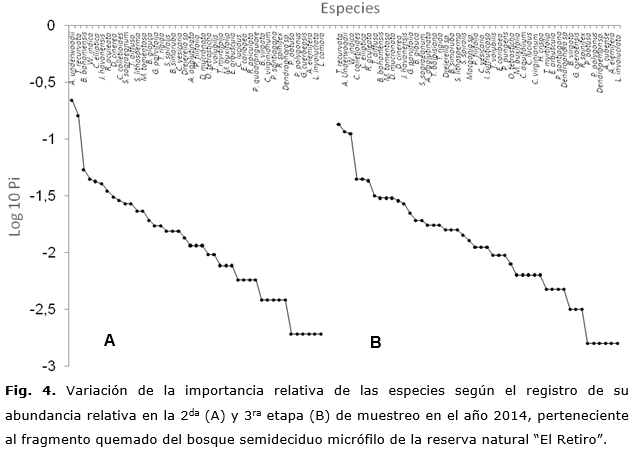
Además de las especies dominantes Agave underwoodii y Waltheria indica, se incorpora la epífita Tillandsia recurvata.
Los cambios rápidos en el número y composición de especies indican que los ensambles iniciales en el área afectada por el fuego son muy inestables, tanto en cantidad como en la calidad de las especies que los componen. Según Halffter (2003), estas características de inestabilidad ambiental de hábitats perturbados permiten la formación de nuevos tipos de hábitats que otras especies pueden utilizar, favoreciendo el incremento de la riqueza específica de la comunidad.
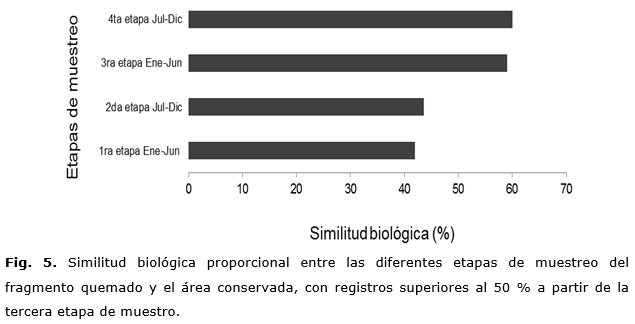
La similitud biológica entre las distintas etapas de muestreo en el fragmento quemado y el área conservada indica un adecuado y rápido proceso de recuperación de los atributos vegetales considerados a partir de la tercera etapa, es decir, luego de 12 meses de monitoreo (Figura 5). En este periodo, se alcanzó un elevado valor de semejanza del 59 %, el cual se corresponde con un tiempo de regeneración natural de aproximadamente tres años a partir del momento de producirse el fuego en el sitio de estudio. Este resultado concuerda con el de Figueredo, 2015, quien reporta un aumento sustancial de la similitud biológica del 49,1 %, luego de 12 meses de producirse el incendio en un hábitat costero de la reserva de biosfera Baconao.
La distribución de los tipos biológicos entre las etapas de muestreo muestra que el desarrollo de las especies arbustivas y epífitas hacia los últimos periodos (3ra y 4ta etapas), caracterizan un estadio superior de recuperación de la flora y la vegetación del sitio afectado por el fuego y una mayor relación con el área conservada (Figura 6).

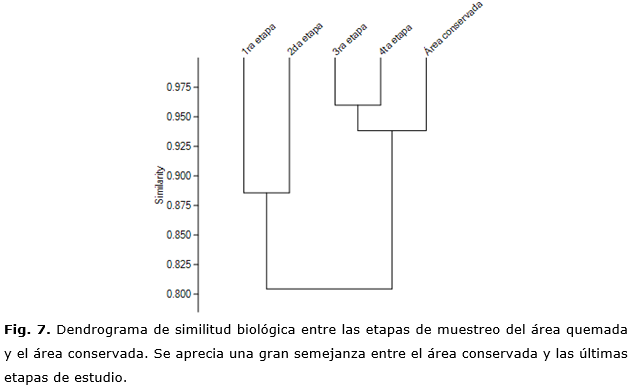
Igualmente, los registros de mayor afinidad biológica se alcanzaron entre la 3ra y 4ta etapa de muestreo, con un valor superior del 95 %. También resulta llamativa la capacidad de recuperación y desarrollo de la vegetación típica de este ecosistema, al registrarse valores superiores del 92 % de similitud biológica en relación con el área conservada en solamente tres años de desarrollo (Figura 7).
Es decir, a medida que transcurre el tiempo, en el área quemada se crean condiciones ecológicas que favorecen el rápido desarrollo por rebrote de algunas especies autóctonas de este tipo de bosque, como: Agave underwoodii, Colubrina elliptica, Waltheria indica y Randia aculeata, entre otras. Además de la llegada y el establecimiento de propágulos de otras especies, cuyas estrategias de reproducción y dispersión dependen de agentes externos, como: Erythroxylum rotundifolium, Bursera simaruba (L.) Sarg., Pilosocereus polygonus, Stenocereus fimbriatus y Passiflora foetida L.var. santiagana Killip. En este sentido, la dispersión de semillas por aves y murciélagos desde las zonas conservadas adyacentes constituyen un factor esencial en el proceso de recuperación de eventos catastróficos Hjerpe y Hedenas, 2001; Holling et al. 1995] consideran que la ausencia de los frugívoros vertebrados en la fase inicial de recuperación del bosque puede conllevar a una sucesión donde predominen las plantas dispersadas por el viento, aumentando el riesgo que suponen las especies exóticas invasoras.
CONCLUSIONES
Se registran 72 especies de plantas fanerógamas, pertenecientes a 60 géneros y 32 familias. El mayor número de especies se registra en el área quemada del bosque semideciduo micrófilo, con 50 especies en la última etapa de muestreo. Se destaca el reporte de 16 nuevos registros para la reserva natural.
La recuperación del área de bosque afectada por el fuego se caracteriza por presentar un periodo inicial muy inestable, tanto en la riqueza como en la composición de especies, con predominio de especies de porte herbáceo y arbustivo de rápido crecimiento y elevada capacidad de rebrote. Y un periodo de estabilización luego de 12 meses de monitoreo, con elevados valores de similitud biológica en relación con el área natural sin afectación, lo cual muestra un adecuado proceso de recuperación de las características típicas de este tipo de bosque.
En la capacidad de recuperación del área quemada, las especies se desarrollan por rebrote vegetativo de sus meristemos y mediante la germinación de semillas, proceso donde intervienen de manera decisiva vertebrados frugívoros como aves y murciélagos.
REFERENCIAS BIBLIOGRÁFICAS
Abrahamson, W. G. 1984. Species responses to fire on the Florida Lake Wales Ridge. Am. J. Bot. 71:35-43.
Acevedo, P. y Strong, M. 2012. Catalogue of seed plants of the West Indies. Smithsonian Institution. Scholarly Press. Washington. 1221 pp.
Bermúdez, G. y M. Durán. 1991. Mapas de precipitación. En Atlas de Santiago de Cuba. Academia de Ciencias de Cuba, 34 pp.
Bisse, J. 1988. Árboles de Cuba. Científico-Técnica, Ciudad de La Habana, 384 pp.
Dayton, P. K. 1971. Competition, disturbance and community organization: the provision and subsequent utilization of space in a rocky intertidal community. Ecol. Monogr. 41:351-389.
Feinsinger, P. 2003. El diseño de estudios de campo para la conservación de la biodiversidad. FAN, Bolivia. 242 pp.
Fernández, I., N. Morales, L. Olivares, J. Salvatierra, M. Gómez y G. Montenegro. 2010. Restauración ecológica para ecosistemas nativos afectados por incendios forestales. Revista Chilena de Historia Natural 83: 461-462.
Ferrand, A. y R. Vallejo. 1998. Long-term plant regeneration afear wildfires in Mediterranean ecosystems of NE Spain. En: Fire Management and Lanscape Ecology (Trabaud, L. Ed.). Centre d´Ecologie Fonctionnelle et Evolutive (CNRS) Montpellier, 155-167.
Figueredo, L. 2015. Diversidad florística de las terrazas costeras de la reserva de la biosfera Baconao. Propuesta de conservación. Tesis doctoral. BIOECO. 366 pp.
García-Lahera, J.P. 2010. Guía de facilitación para el trabajo con la literatura de referencia sobre la flora de Cuba. Versión III. Editorial Feijóo, Villa Clara, Cuba. 158 pp.
Gill, A.M. 1981. Fire adaptive traits of vascular plants. See Ref. 137:208-230.
González Torres, L.R., Palmarola, A., González Oliva, L., Bécquer, E.R., Testé, E. & Barrios, D. (Eds.) 2016. Lista roja de la flora de Cuba. Bissea 10 (número especial 1): 1-352.
Halffter, G. 2003. Sobre diversidad biológica: una presentación, dos conferencias y un apéndice. Bol. S.E.A. 33:1-17.
Halffter, G. y C. Moreno. 2005. Significado biológico de las Diversidades Alfa, Beta y Gamma, 5-17. En G. Halffter, J. Soberón, P. Koleff y A. Melic (eds.). m3m: Monografías Tercer Milenio. Zaragoza, España.
Hammer, Ø. D. Harper y P. Ryan. 2001. PAST: Paleontological Statistics software package for education and data analysis. Palaeontologia Electronica, 4(1):1-9.
Harrison, S. y E. Bruna, 1999. Habitat fragmentation and–large conservation: what do we know for sure? Ecography 22:225-232.
Keeley, J.E. 1981. Reproductive cycles and fire regimes. See Ref. 137:231-277.
Hjerpe, J., H. Hedena y T. Elmqvist. 2001. Tropical Rain Forest Recovery from Cyclone Damage and Fire in Samoa. Biotropica 33(2):249–259.
Holling, C., D. Schindler, B. Walker y J. Roughgarden. 1995. Biodiversity in the functioning of ecosystems: an ecological synthesis. En C. Perrings, K. Mahler, C. Folke, C. Holling, and B. Jansson (eds.). Biodiversity loss: economic and ecological issues. Cambridge University Press, Cambridge, England.
León, Hno. 1946. Flora de Cuba. Vol.1. Contrib. Ocas. Museo Hist. Nat. Col. La Salle, La Habana. No. 8. 441 pp.
León, Hno. y Hno. Alaín. 1951. Flora de Cuba. Vol. 2. Contrib. Ocas. Museo Hist. Nat. Col. La Salle, La Habana. No. 10. 456 pp.
León, Hno. y Hno. Alaín. 1953. Flora de Cuba. Vol. 3. Contrib. Ocas. Museo Hist. Nat. Col. La Salle, La Habana. No. 13. 502 pp.
León, Hno. y Hno. Alaín. 1957. Flora de Cuba. Vol. 4. Contrib. Ocas. Museo Hist. Nat. Col. La Salle, La Habana. No. 16. 556 pp.
Magurran, A. E. 1988. Ecological diversity and its measurement. Princeton University Marrugan. Press New Jersey, 179 pp.
Montenegro, U. 1991. Temperatura media anual, escala 1: 500 000. En: Atlas de Santiago de Cuba. Academia de Ciencias de Cuba. p. 26.
Samek, V. 1973. Regiones fitogeográficas de Cuba. Academia de Ciencias de Cuba. Ser. Forestal 15.
Sánchez, M., Álvarez, L., y Acosta, G. 2007. Plan de Manejo para la Reserva Natural El Retiro. BIOECO. Inédito. 87 pp.
Sørensen, T. 1948. A method of establishing groups of equal amplitude in plant sociology based on similarity of species content. Det Kong. Danske Vidensk. Selsk. Biol. Skr. 5(4):1-34.
Sousa, W. 1984. The role of disturbance in natural communities. Ann. Rev. Ecol. Syst. 15:353-391.
Szejner, P., C. Le Quesne, M. E. González y D. A. Christie. 2011. Recuperación de bosques de Pilgerodendron uviferum (D. Don) Florin luego de perturbaciones antrópicas en la Cordillera de la Costa de Valdivia, Chile. Gayana Bot. 68(2): 196-206.
Trabaud, L. 1998. Recuperación y regeneración de ecosistemas mediterráneos incendiados. Serie Geográfica 7:37-47.