
Caracterización fitoquímica de SamaneaSaman (Jacq.) Merr. (algarrobo)
Revista Cubana de Ciencias Forestales. 2017, 5(1):49-61
Caracterización fitoquímica de SamaneaSaman (Jacq.) Merr. (algarrobo)
Phytochemical characterization of SamaneaSaman Merr (Jacq) Merr.(Algarrobo)
Jorge C. Milián Domínguez1, Omaida Iglesias Monroy2, Humberto Valdés Hernández3
1Doctor en Ciencias Pedagógicas. Universidad de Pinar del Río «Hermanos Saíz
Montes de Oca».
Correo electrónico:jorgemdo@upr.edu.cu
2Máster en Ciencias de la Educación. Universidad de Pinar del Río «Hermanos
Saíz Montes de Oca».
Correo electrónico: omaida.iglesias@upr.edu.cu
3Alumno ayudante de cuarto año de Agronomía. Universidad de Pinar del Río
«Hermanos Saíz Montes de Oca».
Correo electrónico: yosvel.ramos@estudiantes.upr.edu.cu
Recibido: 12 de julio de 2016.
Aprobado: 6 de marzo de 2017.
RESUMEN
La provincia de Pinar del Río es la de mayor superficie boscosa de la nación y esto ha hecho que las investigaciones relacionadas con la temática forestal tengan, en esta universidad, una elevada prioridad. Por tal motivo, se realizó una caracterización fitoquímica integral de Samanea saman (algarrobo), follaje, corteza, flores y frutos, para determinar la presencia de metabolitos secundarios y valorar sus potencialidades desde el punto de vista agroforestal. Como métodos fundamentales de trabajo se empleó tamizaje fitoquímico, análisis histórico-lógico, la observación y la recolección de muestras. Dentro de los principales resultados del estudio de los distintos extractos, se demostró la presencia de sustancias como flavonoides, alcaloides, carbohidratos reductores, taninos, saponinas y mucílagos.
Palabras clave: metabolitos secundarios, fitoquímica, extracto.
ABSTRACT
The province of Pinar del Rio is the largest forest area in the nation and this is the reason for which the research related to forest issues at this university have a high priority. Therefore, a comprehensive phytochemical characterization of Samanea saman (carob), foliage, bark, flowers and fruits was performed to determine the presence of secondary metabolites and to evaluate their potential. As fundamental working methods phytochemical screening, historical and logical analysis, the study of documents, observation and collection of samples is used. Among the main results of the study of the various extracts, the presence of substances suchas flavonoids, alkaloids, reducing carbohydrates, tannins, saponins and mucilage were demonstrated.
Key words: secondary metabolites, phytochemical, extract.
INTRODUCCIÓN
Samaneasaman(Jacq.)Merr. es un árbol de gran tamaño, oriundo del trópico seco americano, que se ha generalizado en todo el trópico húmedo y subhúmedo. Se extiende desde México, por toda la América Central hacia Colombia y Venezuela en Suramérica. Además, se encuentra naturalizado y ampliamente disperso en la mayor parte de las islas caribeñas, principalmente en Cuba, Jamaica, Puerto Rico e Islas Vírgenes, así como en las islas del Pacífico (Staples y Elevitch, 2006).
Es un árbol que brinda excelente sombra, madera, que produce y distribuye gran cantidad de frutos (vainas) de alta calidad nutritiva, que son un importante suplemento forrajero para el ganado durante el período poco lluvioso. Su incorporación a las dietas, en niveles entre 10-30 %, muestra incremento en peso y en producción de leche en vacas lecheras y otras especies productivas (Roncallo, 2009).
Su corteza es rugosa, pardo grisáceo oscura, con líneas horizontales. Las hojas son compuestas, bipinnadas de 3-9 pares de hasta 1 dm. de largo, de 2-4 dm. de longitud, raquis piloso. Las hojas son ligeramente sensibles a la luz y se cierran por la noche (Staples y Elevitch, 2006 y Schmidt, 2008).
Samaneasaman florece entre enero y mayo, con variaciones que dependen de la geografía del lugar donde crece; hay evidencias que, en Cuba, tiene una floración en octubre. El pico de floración ocurre en abril y mayo. Las flores son de color rosa claro, dispuestas en umbelas. Se reúnen en inflorescencias vistosas, situadas al final de las ramas. Los frutos son legumbres o vainas oscuras de 8 a 20 cm. de largo. Se utiliza como forrajera por sus legumbres verdes y por sus semillas que son comestibles. La maduración de la fruta se produce de febrero a mayo. Las semillas son engrosadas, oblongas, elipsoidales, de 8-11,5 mm. de largo y 5-7,5 mm. de ancho, ligeramente achatadas por los lados, de color marrón. Cada vaina dispone de 15-20 semillas. También se cultiva como ornamental.
Las plantas producen una diversidad de sustancias, producto del metabolismo secundario, algunas responsables de la coloración y aromas de flores y frutos; otras vinculadas con interacciones ecológicas, como es el caso de la atracción de polinizadores; algunas de estas propiedades las hacen muy atractivas para los animales.
Algunos metabolitos secundarios solo están presentes en determinadas especies y cumplen una función ecológica específica como, por ejemplo, atraer a los insectos para transferirles el polen, o a animales para que estos consuman sus frutos y así poder diseminar sus semillas; también pueden actuar como pesticidas naturales de defensa contra herbívoros o microorganismos patógenos, incluso como agentes alelopáticos (sustancias que permiten la competición entre especies vegetales), también se pueden sintetizar metabolitos secundarios en respuesta a daño en algún tejido de la planta, así como contra la luz ultravioleta y otros agentes físicos agresivos, incluso actuar como señales para la comunicación entre plantas con microorganismos simbiontes.
En estudios biológicos más recientes, se determinó que la mayoría de los metabolitos secundarios cumplen funciones de defensa contra predadores y patógenos; actúan como agentes alelopáticos (que son liberados para ejercer efectos sobre otras plantas), o para atraer a los polinizadores o a los dispersores de las semillas.
Los metabolitos secundarios de las plantas pueden ser divididos en 3 grandes grupos, con base en sus orígenes biosintéticos:
1. Terpenoides. Todos los terpenoides, tanto los que participan del metabolismo primario como los más de 25, 000 metabolitos secundarios, son derivados del compuesto IPP (Isopentenil difosfato o «5-carbono isopentenil difosfato») que se forma en la vía del ácido mevalónico. Es un grupo grande de metabolitos con actividad biológica importante (Goodwin,1971). Están distribuidos ampliamente en las plantas y muchos de ellos tienen funciones fisiológicas primarias. Unos pocos, como los que forman los aceites esenciales, están restringidos a solo algunas plantas.
2. Compuestos fenólicos y sus derivados. Los más de 8.000 compuestos fenólicos que se conocen están formados por la vía del ácido shikímico o por la vía del malonato/acetato.
3. Compuestos nitrogenados o alcaloides. Los 12,000 alcaloides que se conocen, que contienen uno o más átomos de nitrógeno, son biosintetizados, principalmente a partir de aminoácidos. Los alcaloides poseen una gran diversidad de estructuras químicas (Robinson, 1981). Son fisiológicamente activos en los animales, aun en bajas concentraciones, por lo que son muy usados en medicina. Ejemplos conocidos son la cocaína, la morfina, la atropina, la colchicina, la quinina, y la estricnina.
En el territorio, la comunidad científica tiene la vista puesta en aportar al desarrollo, desde la explotación con sostenibilidad de los recursos forestales y, dentro de esta actividad, el aprovechamiento de los residuos provenientes de esta industria para la obtención de diferentes productos. Este trabajo tiene como objetivo: caracterizar fitoquímicamente follaje, corteza, flores y frutos del Samanea saman (algarrobo) para la determinación de los metabolitos secundarios presentes.
MATERIALES Y MÉTODOS
Selección y Caracterización del área de estudio
El área de estudio seleccionada se encuentra en la Finca «Los Márquez» de la CCS Fortalecida «Pedro Saidén», perteneciente al municipio de Pinar del Río. La selección de esta área está dada, fundamentalmente, por la cercanía al área de investigaciones de la Universidad de Pinar del Río donde se procesa la materia prima (follaje, corteza, flores y frutos de Samanea saman), lo que trae consigo un ahorro significativo por transportación y tiempo. Además, se conoce que la finca en cuestión posee más de 20 algarrobos en diferentes estadios de desarrollo, lo que es posible realizar diferentes estudios y aprovechar los volúmenes de material disponible.
Toma de muestras de corteza, follaje, flores y frutos de Samanea saman
El material se tomó de árboles en diferentes estadios de desarrollo, incluso se realizaron análisis de corteza de árboles talados, con edades comprendidas entre 5 y 70 años en los meses de septiembre de 2015 y enero de 2016; los ejemplares seleccionados se encontraban a una distancia de 150 m. de la carretera, siguiendo criterios de Ortega (2010), para evitar la contaminación con sustancias químicas producidas por la combustión de los motores de los autos. La toma del material se realizó de forma aleatoria, con material de árboles en diferentes estados de desarrollo. El material recolectado se mezcló para obtener muestras homogéneas, según Norma GOST 13496. 0-70, (Yagodin, 1981)
Procesamiento de la muestra
El material de estudio fue trasladado al Laboratorio de investigaciones de la Universidad de Pinar del Río, donde, como paso inicial e imprescindible, fue desfibrado de forma manual y en un molinillo rústico para obtener partículas de 7-8 mm., según Norma 8770-58 (Yagodin,1981), citado por (Ortega, 2010). Lo anterior facilita la extracción de los componentes activos de la muestra.
Obtención de los extractos
Para la preparación de los extractos, se tomaron las partes aéreas de las plantas (hojas, corteza, flores y frutos). El follaje, las flores y los frutos se procesaron verdes, además, las hojas, frutos y corteza se procesaron secas en condiciones naturales, durante 72 horas y posteriormente en la estufa durante 24 horas a 60 oC para luego triturarlas finamente, a tamaño de partícula 0,8 ì (An et al., 1997). De este material, se tomaron 10 g. y se siguió el esquema propuesto.
Las maceraciones se realizaron por espacio de 48 horas. Los solventes de cada maceración fueron concentrados por separado a presión reducida hasta un volumen de 5 mil.
Análisis de índices de calidad de las muestras
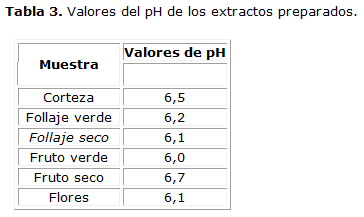
Determinación del pH de la disolución
El pH de la disolución se determinó con 0,9 - 1,0000 g. de la muestra en 100 mil. de agua destilada, mediante potenciometría directa en un pH metro 211 marca HANNA.
Análisis de la humedad
La determinación del contenido de humedad se realiza mediante el método gravimétrico. Se toman entre 5 y 10 g. de las muestras, se pesan en balanza analítica con precisión de ± 0,0001g., y se secan en estufa a temperatura de 103 ± 2 ºC hasta obtener masa constante, según Norma estándar T- 264 cm. - 97 (TAPPI, 1998).
Para ejecutar este ensayo, se empleó una balanza analítica digital Sartorius MC 1, AC 210s, estufa Baxun y Ziehen.
El % de humedad: Se determinó empleando los criterios que la definen como la diferencia entre la masa húmeda y la masa seca por cien (Álvarez Godoy, y Pérez Meléndez, 2005).
Caracterización fitoquímica
El esquema que se propone utiliza la extracción sucesiva con solventes de polaridad creciente, con la finalidad de lograr el mayor agotamiento de la droga, ensayándose en cada extracto los metabolitos que de acuerdo con su solubilidad pueden ser extraídos en estos solventes. (Anexo 2)
Tabla 1. Resultados de los ensayos realizados.
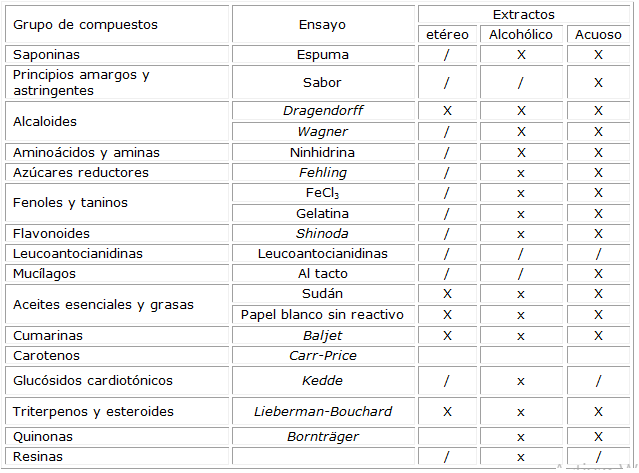
Los espacios con X indican ensayos que se le realizaron al extracto, / significa que no se le realizó.
Además, se realizaron otras pruebas que indican la presencia de metabolitos, tales como:
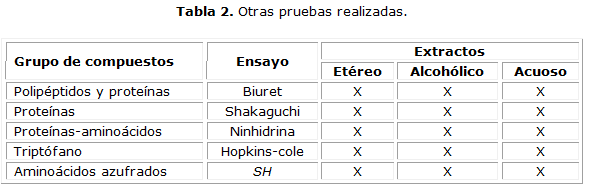
Los espacios con X indican esos ensayos que se le realizaron al extracto, / significa que no se le realizó.
RESULTADOS Y DISCUSIÓN
Determinación del pH
Determinación de los parámetros de humedad.
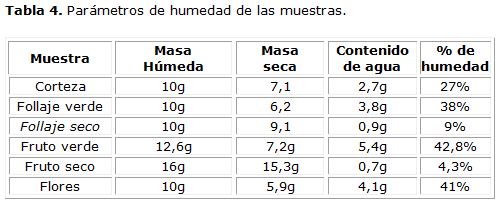
Se puede apreciar que los mayores contenidos de humedad lo presentan los frutos verdes y las flores, y los menores valores corresponden al follaje y fruto secos; estos parámetros indican que la corteza, el follaje y los frutos secos pueden ser conservados por un periodo de tiempo prolongado, lo que acentúa su importancia desde el punto de vista investigativo.
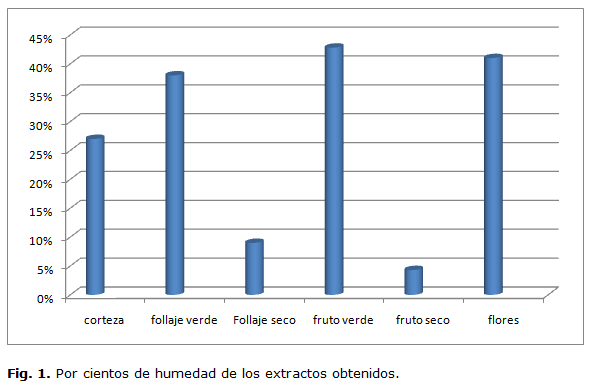
La determinación del contenido de humedad indicó la cantidad de agua involucrada en la composición de los mismos. El contenido de humedad se expresa, generalmente, como porcentaje; las cifras varían en los productos naturales. En los tejidos vegetales y animales, existen dos formas generales: agua libre y agua ligada, como soluto o como solvente; en forma libre, formando hidratos o como agua adsorbida.
Los ensayos realizados en el estudio fitoquímico, con el empleo de las técnicas seleccionadas, evidenciaron la presencia de una gama importante de metabolitos secundarios.
Caracterización fitoquímica
El estudio fitoquímico evidenció la presencia de un grupo importante de metabolitos secundarios.
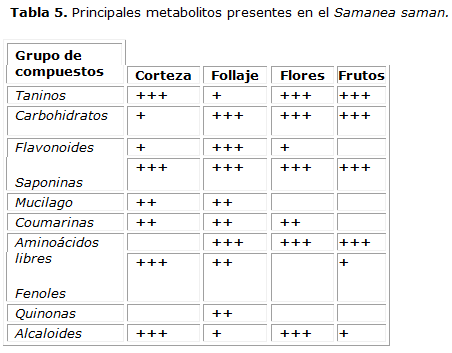
Los espacios en blanco significan que a esos ensayos no se les realizaron el extracto, + significa que se obtuvo una respuesta positiva para ese metabolito en el extracto, - significa que se obtuvo una respuesta negativa para ese metabolito en el extracto.
DISCUSIÓN
La corteza ha sido poco estudiada como se puede observar en la tabla; en el estudio fitoquímico realizado, se detectaron diversos metabolitos; se evidenció en los ensayos de Dragendorff la aparición de opalescencia, lo que demostró la existencia de alcaloides. Los alcaloides poseen una gran diversidad de estructuras químicas (Robinson, 1981). Son fisiológicamente activos en los animales, aun en bajas concentraciones, por lo que son muy usados en medicina. Ejemplos conocidos son la cocaína, la morfina, la atropina, la colchicina, la quinina, y la estricnina.
Al realizar el ensayo de cloruro férrico, se comprobó la presencia de abundantes taninos, sobre todo del tipo pirocatecólicos, por la coloración verde intensa que tomó la muestra. En los extractos más polares, alcohólico y acuoso, se detectaron azúcares, flavonoides, quinonas y resinas. Además, en el extracto acuoso se encontraron saponinas y principios amargos y astringentes.
Por otra parte, resulta interesante señalar, en esta especie cubana, la presencia de flavonoides y triterpenos compuestos que también han sido encontrados en otras especies como: Ceratonia silicua que han mostrado sus efectos farmacológicos relevantes sobre los sistemas nervioso y cardiovascular, entre otros (Dusek, 2002; Bronce, 2007; Tie-shan, 2011; Lee H, 2010 y Robinson, 1981).
Los resultados obtenidos para el follaje evidencian la presencia de metabolitos como mucilagos, saponinas, azúcares reductores que se asemejan a los presentados por Delgado (2012), respecto a esta misma especie, pero en la región oriental del país; los solventes más polares donde se evidencia la mayor cantidad de metabolitos fueron identificados.
Al hacer un análisis de los metabolitos secundarios presentes en los frutos, se pudo apreciar la presencia de aminoácidos libres y alcaloides. Llama la atención la presencia de flavonoides, lo que indica que sus propiedades antioxidantes pueden ser empleadas en la obtención de otros productos bioactivos. Los frutos sirven de alimento para el ganado, lo cual es riesgoso si es consumido en abundancia, ya que las semillas poseen el alcaloide pitecolobina, que es tóxico, con propiedades abortivas (Delgado et al., 2012).
Estudios realizados indicaron que, en el mesocarpio carnoso, los azúcares representan el 32,65 % del contenido total de nutrientes y, de los cuatro tipos de azúcares identificados, la fructosa fue predominante con una concentración de 16,20 %. El fruto del algarrobo es oleífero. El aceite que se obtiene de las semillas contiene 5,6 % de ácidos grasos libres y está compuesto por nueve ácidos grasos; de ellos, más del 90 % son insaturados (Esuoso, 1996).
Al observar los resultados del análisis fitoquímico a las flores, es significativa la presencia de una variada cantidad de metabolitos secundarios, donde resaltan los alcaloides y se observa opalescencia en el tubo de ensayos de los extractos alcohólico y acuoso. En el caso de los flavonoides, el alcohol amílico se colorea de amarillo naranja; en la presencia de los taninos, aparece una coloración verde. Esto posibilitaría continuar profundizando en su identificación para el empleo, en la industria, de la cosmética y productos medicinales.
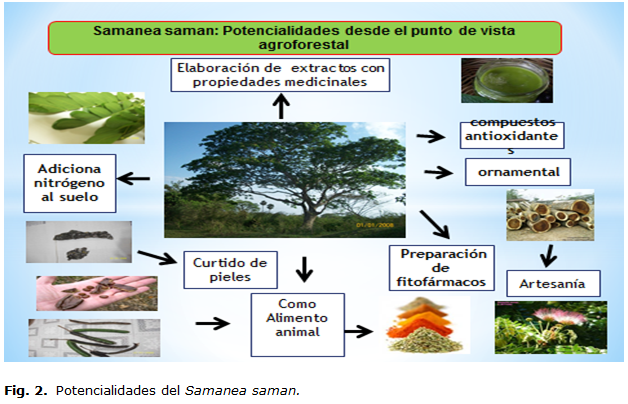
En resumen, el estudio realizado evidencia una amplia aplicación por la presencia de una gran cantidad de metabolitos secundarios con propiedades bioactivas; eso hace, de las partes estudiadas de esta especie, una importante fuente para el desarrollo desde el punto de vista agroforestal; sus frutos son legumbres o vainas oscuras de 8 a 20 cm. de largo. Se utiliza como forrajera por sus legumbres verdes y secas, además, por sus semillas que son comestibles por animales silvestres y el ganado; en algunas regiones de América las emplea el mismo hombre. También se cultiva como ornamental, tiene gran valor como sombra para el ganado en los pastizales.
Además, en el país, cada día su madera es más estimada en algunos lugares para el tallado artesanal y la elaboración de muebles. Se ha comprobado experimentalmente que la descomposición de las hojas aporta nitrógeno a los suelos, lo que le aporta valor agregado desde el punto de vista agroecológico a la especie.
El tamizaje fitoquímico realizado evidenció que en la corteza y los frutos aparecen identificados los mayores números de metabolitos secundarios, seguidos de las flores. Los metabolitos más abundantesson alcaloides, taninos, carbohidratos, saponinas, aminoácidos, azúcares reductores y flavonoides.
El análisis de los resultados del estudio fitoquímico al Samanea saman indica que esta especie tiene amplias posibilidades de ser empleada para la obtención de productos naturales (sustancias bioactivas y aceites esenciales); además, la obtención de compuestos antioxidantes, a partir de clorofila para su empleo en la medicina natural, la obtención de sustancias empleadas en el proceso de curtido de pieles, la elaboración de bebidas y la preparación de extractos acuosos de la planta demostraron actividad inhibitoria de Escherichiacoli, Staphylococcus aureus y Candidaalbicans. (Obasi, 2010y Jagessar, 2011), como fuente natural de antimicrobianos y antifúngicos, por la presencia de metabolitos (principalmente taninos condensados), capaces de cumplir estas funciones (Ferdous, 2010).
En extractos de la corteza de Samanea saman, se encontraron buena actividad antioxidante y potencial citotóxico. Trusharkumar (2011) informó actividad antioxidante y órgano-protectora en la corteza y lo atribuyó a la presencia en ella de compuestos polifenólicos como los flavonoides y taninos. Aquí solo se mencionan algunas de las aplicaciones que tienen la corteza, el follaje, las flores y los frutos que constituyen una fuente natural para potenciar el desarrollo de la agricultura con criterios de sostenibilidad.
Con el objetivo de realizar un estudio para la identificación de los principales metabolitos secundarios de Samanea saman y el posible potencial de la especie, se concluye, planteando que:
Samanea saman es una especie con alto potencial, dada la cantidad de metabolitos secundarios que le atribuyen propiedades nutritivas, bioactivas, medicinales, a las diferentes partes del árbol, incluyendo su madera, lo que lo convierte en una especie económica de interés.
Los principales metabolitos secundarios de interés encontrados están identificados como flavonoides, taninos, terpenoides, azúcares reductores, alcaloides y taninos; entre otros, por lo que es una fuente interesante de investigación con respecto a la obtención de productos naturales.
REFERENCIAS BIBLIOGRÁFICAS
[1] ANANTASOOK, N. y WANAPAT M. Influence of Rain Tree Pod Meal Supplementation on Rice Straw Based Diets Using In vitro Gas Fermentation Technique. Asian-Australasian Journal of Animal Sciences (AJAS) [En línea]. 2012, 25 (3). 325-334. ISSN: 1976-5517. DOI: https://doi.org/10.5713/ajas.2011.11131. Disponible en: http://www.ajas.info/journal/view.php?viewtype=cited&number=22687
[2] BABAYEMI, O.J; INYANG, U.A; IFUT O.J y ISAAC, L.J. Nutritional Value of Cassava Wastes Ensiled with Albizia saman Pod as Feed for Ruminants in Off Season. Agricultural Journal [En línea]. 2010, 5(3). 220-224. ISSN: 1816-9155. Disponible en: http://docsdrive.com/pdfs/medwelljournals/aj/2010/220-224.pdf
[3] CECEONELLO, G., BENEZRA, M. y OVISPO, N.E. Composición química y
degradabilidad ruminal de los frutos de algunas especies forrajeras leñosas de un bosque seco
tropical. Zootecnia Tropical [En línea]. 2003, 21(2). 149-165. ISSN: 0798-7269. Disponible
en: https://www.researchgate.net/profile/Nestor_Obispo/publication/43564276_Chemical_composition_and_ruminal_degradability_of_some_woody
_legumes_fruits_of_the_tropical_dry_forest/links/53e5018a0cf2fb748711258d.pdf
[4] CONKLIN, N.L.; MCDOWELL, R.E. y VAN SOEST, P.J. Ranking twenty-two tropical browse species from Guanacaste, Costa Rica. TURRIALBA: Revista Interamericana de Ciencias Agrícolas [En línea], 1991, octubre-diciembre, 41(4). 615-450. ISSN: 0041-4360. Disponible en: https://books.google.com.cu/books?hl=en&lr=&id=V5pCjFOvwQkC&oi=fnd&pg=PA615&dq=Ranking+twenty -two+tropical+browse+species+from+Guanacaste,+Costa+Rica.&ots= -VlsmPZeoY&sig=oHx910-AxqRiEXRL03rLyRnM418&redir_esc=y#v=onepage&q=Ranking%20twenty-two%20tropical%20browse%20species%20from%20Guanacaste%2C%20Costa%20Rica.&f=false
[5] CHICCO, C. F.; GARBATI, S.T. y HULLER, H.B. Una nota sobre el uso del fruto del samán (Pithecolobium saman) en la alimentación del cerdo. Agronomía Tropical, 1973, 23(3). 263-267.
[6] CHUMPAWADEE, S., y PIMPA, O. Effect of Fodder Tree as Fiber Sources in Total Mixed Ration on Feed Intake, Nutrient igestibility, Chewing Behavior and Ruminal Fermentation in Beef Cattle. Journal of Animal and Veterinary Advances. 2009, 8(7). 1279.
[7] DELGADO, D.C.; BELTRÁN, J.; HERAS, R.; CAIRO, J. y HORTA, Y. Samanea saman, a multi-purpose tree with potentialities as alternative feed for animals of productive interest. Cuban Journal of Agricultural [En línea]. 2014, 48(3). 205-212. ISSN: 2079-3480. Disponible: http://cjascience.com/index.php/CJAS/article/view/573
[8] DELGADO, D. C., GONZÁLEZ, R., GALINDO, J., CAIRO, J., & ALMEIDA, M. Potential of Trichantera gigantea and Morus alba to reduce in vitro rumen methane production. Cuban Journal of Agricultural Science, 2007. 41(4), 319-322.
[9] DELGADO, D.C.; LA O, O. y CHONGO, B. Bromatological composition and in situ ruminaldegradabilityof tropical legumes with perspectives of usein cattle productive systems. Cuban Journal of Agricultural Science, 41(4), 323-326.
[10] DELGADO, D.C.; LA O, O. y SANTOS, Y. Cinética de la degradación ruminal in situ de cuatro árboles tropicales: Leucaena leucocephala, Enterolobium cyclocarpum, Sapindus saponaria y Gliricidia sepium. Revista Cubana Ciencias Agrícolas [En linea]. 2001, 35(2). 142-145. ISSN: 0034-7485. Disponible en: http://www.redalyc.org/articulo.oa?id=193018220008
[11] DURR, P. A. The biology, ecology and agroforestry potential of the raintree, Samanea saman (Jacq.) Merr. Agroforestry Systems [En línea]. 2001, marzo, 51(3). 223-237. ISSN: 1572-9680. Disponible en: http://link.springer.com/article/10.1023/A:1010765022497
[12] ELEVITCHSATTER, R. L. et al. The effects of blue and far red light on rhythmic leaflet movementsin Samanea (saman) and Albizzia (julibrissin). Plant Physiology [En línea]. 1981, mayo, 67(5). 965- 968. ISSN: 1532-2548. doi: http://dx.doi.org/10.1104/pp.67.5.965. Disponible en: http://www.plantphysiol.org/content/67/5/965.short
[13] FERDOUS, A.; IMAM, M. Z. y AHMED, T. Antioxidant, Antimicrobial and Cytotoxic Activities of Samanea saman (Jacq.) Merr. Stamford Journal of Pharmaceutical Sciences [En línea]. 2010, 3(1). 11-17. ISSN 1999-7108. DOI: 10.3329/sjps. v3i1.6792. Disponible en: http://www.banglajol.info/index.php/SJPS/article/view/6792
[14] GARCÍA, D.E. et al. Composición proximal, niveles de metabolitos secundarios y valor nutritivo del follaje de algunos árboles forrajeros tropicales. Archivos de Zootecnia Tropical [En linea]. 2006, 55(212). 373-384. ISSN 0004-0592. Disponible en: https://dialnet.unirioja.es/servlet/articulo?codigo=2253493
[15] GARCÍA D. E. y MEDINA, M.G. Composición química, metabolitos secundarios, valor nutritivo y aceptabilidad relativa de diez árboles forrajeros. Zootecnia Tropical [En línea]. 2006, 24(3). ISSN: 0798-7269. Disponible en: http://avpa.ula.ve/rev_zoot/vol24_num3_2006/articulos/garcia_e.htm
[16] GARCÍA, D. E. et al. Preferencia de vacunos por el follaje de doce especies con potencial para sistemas agrosilvopastoriles en el Estado Trujillo, Venezuela. Pastos y Forrajes [En linea]. 2008, julio-septiembre, 31(1). ISSN 0864-0394. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03942008000300006
[17] QUANSAH, E. S., Y MAKKAR, P. S. Use of lesser-known plants and plant parts as animal feed resources in tropical regions. FAO. Animal Production and Health Working Paper, 2012, (8), 1-32.
[18] ROCK, J. F. Leguminous trees of Hawaii. Honolulu: Hawaiian Sugar Planters' Association Experiment Station, 1920.
[19] SATTER, R.L. et al. The effects of blue and far red light on rhythmic leaflet movements in Samanea (saman) and Albizzia (julibrissin). Plant Physiology [En línea]. 1981, mayo, 67(5). 965-968. ISSN: 1532-2548. doi: http://dx.doi.org/10.1104/pp.67. Disponible en: http://www.plantphysiol.org/content/67/5/965.short
[20] SCHMIDT, D. Communication personal. Berkeley, CA: Pacific Southwest Forest and Range Experiment Station, 2008.
[21] VALENTIM, J.F.; CARNEIRO, J. y VAZ, F.A. Growth of tropical forage grasses and legumes under shade. Pesquisa Agropecuaria Brasileira [En línea]. 2004. Marzo, 39(3). ISSN 0100-204X. Disponible en: http://www.scielo.br/scielo.php?pid=S0100-204X2004000300009&script=sci_arttext